Geberauchsanweisung / Beispackzettel für Brustimplantate von Motiva Implants® Ergonomix2® Sterile aus Silikon
ACHTUNG:
- Dieses Produkt darf nur von in ihrem Land ordnungsgemäß approbierten Chirurgen verwendet werden, die eine qualifizierte Schulung absolviert haben. Die Verwendung dieses Produkts durch nicht qualifizierte Ärzte kann suboptimale ästhetische Resultate sowie schwere unerwünschte Wirkungen zur Folge haben.
- Gemäß Bundesgesetzgebung (USA) darf dieses Produkt nur von einem approbierten plastischen Chirurgen verwendet werden.
EINFÜHRUNG
Diese Produktinformation gibt einen Überblick über die wichtigsten Informationen zu den Motiva Implants® Ergonomix2® sterilen Brustimplantaten aus Silikon von Establishment Labs und umfasst Folgendes: Produktbeschreibung, Indikationen, Kontraindikationen, Warn- und Vorsichts- hinweise, mit der Patientin zu besprechende relevante Themen, unerwünschte Ereignisse, sonstige gemeldete Gegebenheiten, Richtlinien für die Produktrücksendung, Produktbewertung, Garantie und Meldungen im Zusammenhang mit Medizinprodukten.
VERWENDUNGSZWECK
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind für die Anwendung bei Patientinnen im Rahmen folgender Verfahren vorgesehen:
- Brustrekonstruktion (primäre Rekonstruktion und Revisionseingriff): Zum Ersatz von Brustgewebe, das aufgrund von Krebs oder eines Traumas entfernt wurde oder sich aufgrund einer schweren Brustanomalie nicht richtig entwickelt hat, sowie Revisionseingriffe zur Korrektur oder Verbesserung der Ergebnisse eines früheren rekonstruktiven brustchirurgischen Eingriffs.
INDIKATIONEN
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind für die Anwendung bei Patientinnen ab 18 Jahren zur Behandlung folgender Gegebenheiten vorgesehen:
- Korrektur angeborener oder erworbener Brustdeformitäten oder -asymmetrien
- Korrektur oder Verbesserung des Ergebnisses einer früheren operativen Brustrekonstruktion
BESCHREIBUNG UND LEISTUNG DES PRODUKTS
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind invasive, dauerhaft implantierbare Medizinprodukte für die Brustrekonstruktion. Alle Implantate bestehen aus sukzessiv quervernetzten Schichten eines hochfesten Silikonelastomers mit der Bezeichnung SuperSilicones® und einer Barriereschicht mit BluSeal+® Technologie, die eine geringe Diffusion gewährleistet und die viskoelastischen Eigenschaften dieser Implantate gegenüber früheren Generationen von Motiva Implants® verbessert. Dieses System wird auch als TrueMonobloc+® Technologie bezeichnet. Die Oberfläche der Hülle bildet SmoothSilk®, eine glatte Oberfläche, die im Negativdruckverfahren in einem einzigen Schritt hergestellt wird, ohne dass zusätzliche Materialien zur Projektion der Oberfläche verwendet werden. Das Motiva Implants® Ergonomix2® Brustimplantat besteht aus einer runden, einlumigen Hülle, einem seitlichen Patch und Silikongelfüllung (ProgressiveGel Ultima®).
Optional ist ein im Gel platziertes Hochfrequenz-Identifikationsgerät, ein sogenannter RFID- Mikrotransponder, für alle Implantattypen erhältlich. Mit dem Mikrotransponder erhält jedes Produkt eine einzigartige elektronische Seriennummer (ESN), anhand derer es zurückverfolgt werden kann, da damit der Zugriff auf eine Datenbank mit Informationen zum Brustimplantat (d. h. Serien- und Chargennummern, Referenznummer, Volumen, Größe und Projektion, Modell, Oberflächentyp, Herstellungsdatum usw.) möglich ist.
Establishment Labs hat die Motiva Implants® Ergonomix2® sterilen Brustimplantate aus Silikon einer
WARNHINWEIS: Brustimplantate wurden mit der Entwicklung von Krebs des Immunsystems in Verbindung gebracht, dem sogenannten Breast-Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). Ausführlichere Informationen sind im Abschnitt BIA-ALCL zu finden.
Patientinnen mit Brustimplantaten sollten regelmäßige klinische Nachkontrolltermine bei ihrem Chirurgen wahrnehmen.
ACHTUNG:
- Dieses Produkt darf nur von in ihrem Land ordnungsgemäß approbierten Chirurgen verwendet
werden, die eine qualifizierte Schulung absolviert haben. Die Verwendung dieses Produkts durch nicht qualifizierte Ärzte kann suboptimale ästhetische Resultate sowie schwere unerwünschte Wirkungen zur Folge haben.
- Gemäß Bundesgesetzgebung (USA) darf dieses Produkt nur von einem approbierten plastischen Chirurgen verwendet werden.
Gebrauchsanweisung
Motiva Implants® Ergonomix2®
Sterile Brustimplantate aus Silikon
Establishment Labs
EINFÜHRUNG
Diese Produktinformation gibt einen Überblick über die wichtigsten Informationen zu den Motiva Implants® Ergonomix2® sterilen Brustimplantaten aus Silikon von Establishment Labs und umfasst Folgendes: Produktbeschreibung, Indikationen, Kontraindikationen, Warn- und Vorsichts- hinweise, mit der Patientin zu besprechende relevante Themen, unerwünschte Ereignisse, sonstige gemeldete Gegebenheiten, Richtlinien für die Produktrücksendung, Produktbewertung, Garantie und Meldungen im Zusammenhang mit Medizinprodukten.
VERWENDUNGSZWECK
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind für die Anwendung bei Patientinnen im Rahmen folgender Verfahren vorgesehen:
- Brustrekonstruktion (primäre Rekonstruktion und Revisionseingriff): Zum Ersatz von Brustgewebe, das aufgrund von Krebs oder eines Traumas entfernt wurde oder sich aufgrund einer schweren Brustanomalie nicht richtig entwickelt hat, sowie Revisionseingriffe zur Korrektur oder Verbesserung der Ergebnisse eines früheren rekonstruktiven brustchirurgischen Eingriffs.
INDIKATIONEN
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind für die Anwendung bei Patientinnen ab 18 Jahren zur Behandlung folgender Gegebenheiten vorgesehen:
- Korrektur angeborener oder erworbener Brustdeformitäten oder -asymmetrien
- Korrektur oder Verbesserung des Ergebnisses einer früheren operativen Brustrekonstruktion
BESCHREIBUNG UND LEISTUNG DES PRODUKTS
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind invasive, dauerhaft implantierbare Medizinprodukte für die Brustrekonstruktion. Alle Implantate bestehen aus sukzessiv quervernetzten Schichten eines hochfesten Silikonelastomers mit der Bezeichnung SuperSilicones® und einer Barriereschicht mit BluSeal+® Technologie, die eine geringe Diffusion gewährleistet und die viskoelastischen Eigenschaften dieser Implantate gegenüber früheren Generationen von Motiva Implants® verbessert. Dieses System wird auch als TrueMonobloc+® Technologie bezeichnet. Die Oberfläche der Hülle bildet SmoothSilk®, eine glatte Oberfläche, die im Negativdruckverfahren in einem einzigen Schritt hergestellt wird, ohne dass zusätzliche Materialien zur Projektion der Oberfläche verwendet werden. Das Motiva Implants® Ergonomix2® Brustimplantat besteht aus einer runden, einlumigen Hülle, einem seitlichen Patch und Silikongelfüllung (ProgressiveGel Ultima®).
Optional ist ein im Gel platziertes Hochfrequenz-Identifikationsgerät, ein sogenannter RFID- Mikrotransponder, für alle Implantattypen erhältlich. Mit dem Mikrotransponder erhält jedes Produkt eine einzigartige elektronische Seriennummer (ESN), anhand derer es zurückverfolgt werden kann, da damit der Zugriff auf eine Datenbank mit Informationen zum Brustimplantat (d. h. Serien- und Chargennummern, Referenznummer, Volumen, Größe und Projektion, Modell, Oberflächentyp, Herstellungsdatum usw.) möglich ist.
Establishment Labs hat die Motiva Implants® Ergonomix2® sterilen Brustimplantate aus Silikon einer gründlichen Designverifizierung und -validierung sowie nicht-klinischen Tests unterzogen, einschließlich Oberflächencharakterisierung, Biokompatibilität, mechanischer, chemischer Eigenschaften und Sterilisation, Gebrauchstauglichkeit, elektromagnetischer Verträglichkeit und elektrischer Sicherheit sowie Studien bezüglich der MRT-Sicherheit. Nachdem die Sicherheit und Leistung des Produkts für seine bestimmungsgemäße Verwendung durch nicht-klinische Tests bestätigt wurde, hat Establishment Labs die Sammlung klinischer Daten zum Produkt fortgesetzt, ergänzt durch Daten, die von gleichwertigen Produkten zusammengetragen wurden.
Das Produkt erfüllt klinisch nachgewiesenermaßen die maßgeblichen Sicherheits- und Leistungs- anforderungen. Die beanspruchte Leistung und Sicherheit des Produkts wurden nachgewiesen, und die mit seiner Verwendung verbundenen Risiken sind bei Abwägung gegenüber den Nutzen für die Patientin akzeptabel.
Wie gemäß internationalen Normen vorgeschrieben sind alle Rohmaterialien für medizinische Anwendungen geeignet, dauerhaft implantierbar und biokompatibel.
Die UDI-DI-Teilenummern der in diesem Dokument behandelten Produkte lauten wie folgt:
- Motiva® Ergonomix2® SmoothSilk®:
7445161Ergo2AX (Standard-Projektion) - Motiva® Ergonomix2® SmoothSilk® mit Qid®:
7445161Ergo2QGK (Standard-Projektion) - Motiva® Ergonomix2® SmoothSilk®:
7445161Ergo2DiamondDH (Diamond-Projektion) - Motiva® Ergonomix2® SmoothSilk® mit Qid®:
7445161Ergo2DiamondQ5T (Diamond-Projektion) - Motiva® Ergonomix2® SmoothSilk® mit Zen®:
7445161Ergo2ZenBQ (Standard- und Diamond-Projektion)
Die Informationen zu den Materialien, denen die Patientin ausgesetzt sein kann, sind in der Tabelle unten angegeben.
| Motiva® Implants Produktserie | Hülle | Patch-System | Gel | Mikrotransponder | ||||
| Super- Standard- Silikondis- persion
(% w/w) |
Super- Silikon- barrriere- Dispersion (% w/w) | Farb- Master- batch
(% w/w) |
Patch (% w/w) | Tauch- beschich- tung
(% w/w) |
Silikongel- füllung
(% w/w) |
Ferrit-Mikro- transponder (Qid®)
(% w/w) |
Nicht- Ferrit-Mikro- transponder (Zen®)
(% w/w) |
|
| Ergonomix2®
Runde Projektion |
1,86–4,35 | 0,38–0,89 | 0,0002– 0,0004 | 0,159– 1,735 | 0,0002– 0,0021 | 92,94–97,60 | 0,007–0,073 | 0,086–0,960 |
| Ergonomix2® Diamond- Projektion | 1,81–7,38 | 0,37–1,51 | 0,0001–
0,0006 |
0,079– 1,386 | 0,0002– 0,0033 | 88,17–97,74 | 0,007–0,118 | 0,087–1,549 |
Die potenzielle Toxizität der in den Tabellen rechts aufgeführten Chemikalien und Metalle wurde sowohl anhand von Toxizitätsprüfungen als auch anhand von Risikoabschätzungen bewertet, um die Stärke der Exposition im Vergleich zu der als wahrscheinlich unbedenklich erachteten Menge zu beurteilen. Basierend auf den aktuellen Ergebnissen und der durchgeführten Risikoanalyse ist es unwahrscheinlich, dass Auslaugungsstoffe/extrahierbare Bestandteile der Ergonomix2® Implantate aus toxikologischer Sicht ein Sicherheitsrisiko darstellen.
Extrahierbare organische Stoffe für halbflüchtige (SVOC-) und nichtflüchtige (NVOC-)Verbindungen in Lösungsmitteln mit unterschiedlichen Polaritätsindizes: gereinigtes Wasser (PW), Hexan (Hex), Ethanol (EtOH), DCM (Dichlormethan) und DMSO (Dimethylsulfoxid).
| Mischung | Komb. Konz.
(μg/Einheit) |
| SVOC (HS-GC/MS) | |
| Hexamethylcyclotrisiloxan (D3) | < 30* |
| Octamethylcyclotetrasiloxan (D4) | < 30* |
| Decamethylcyclopentasiloxan (D5) | < 30* |
| Dodecamethylcyclohexasiloxan (D6) | < 30* |
| L3, MDM: Octamethyltrisiloxan | < 30* |
| L5, MD3M: Dodecamethylpentasiloxan | < 30* |
| SVOC (GC/MS) | |
| 4-Chlorbenzoesäure | 30 |
| 2,4-Dichlorbenzoesäure | 25,9 |
| Hexamethylcyclotrisiloxan (D3) | < 20** |
| Octamethylcyclotetrasiloxan (D4) | 99,2 |
| Decamethylcyclopentasiloxan (D5) | 83,9 |
| Dodecamethylcyclohexasiloxan (D6) | 394 |
| Tetradecamethylcycloheptasiloxan (D7) | 503 |
| Hexadecamethylcyclooctasiloxan (D8) | 172,2 |
| Octadecamethylcyclononasiloxan (D9) | 381,5 |
| Eicosamethylcyclodecasiloxan (D10) | 1.006 |
| 2,2,4,4,6,8-Hexamethyl-6,8-diphenylcyclotetrasiloxan | 2.602 |
| 2,2,4,4,6,6,8,10-Octamethyl-8,10-diphenyl-cyclopentasiloxan | 62.646 |
| Zyklisches Polydimethylsiloxan-Oligomer (kombinierte Werte)*** | 10.822 |
| Mischung | Komb. Konz.
(μg/Einheit) |
| Dimethylsiloxan-Methylphenylsiloxan-Copolymer
(kombinierte Werte)*** |
2.602 |
| Siloxan (kombinierte Werte)*** | 11.344 |
| 1,3,5,7-Tetramethyltetraphenylcyclotetrasiloxan | 7.950 |
| 2,4,6,8,10-Pentamethyl-2,4,6,8,10-pentaphenyl- 1,3,5,7,9,2,4,6,8,10-pentaoxapentasilecan-Isomer (kombinierte Werte)*** | |
| Polymethylphenylsiloxan-Oligomer (kombinierte Werte)*** | 4.780 |
| 2-Ethylhexanol | 79,3 |
| Lineares Polydimethysiloxan-Oligomer (kombinierte Werte)*** | 325 |
| Ester/Carbonsäure enthaltende ungesättigte Verbindung | 20 |
| Heptasiloxan, 1,1,3,3,5,5,7,7,9,9,11,11,13, 13-tetradecamethyl- | 26 |
| Octasiloxan, 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,
15-hexadecamethyl- (kombinierte Werte)*** |
3.606 |
| Heptasiloxan, Hexadecamethyl (kombinierte Werte)*** | 3.677 |
| Octamethyltrisiloxan (L3) | < 20** |
| Dodecamethylpentasiloxan (L5) | < 20** |
| > L6 | 5.800 |
| Polysiloxan-Fragment (kombinierte Werte)*** | 1.883 |
| NVOC (LC/UV) | |
| Palmitinsäure | 64,6 |
| Stearinsäure | 74,2 |
| Erucamid | 9,69 |
| NVOC (LC/UV-Vis) | |
| Siloxan (kombinierte Werte)*** | 75.035 |
| Di(2-ethylhexyl)phthalat | 2.629 |
| Unbekannt***
(n = 9) |
573–994 |
| NVOC (UPLC-MS) | |
| Chlorhaltige Verbindung (kombinierte Werte)*** | 69 |
| Amidhaltige aliphatische Verbindung mit unbekannter Koelution. | 27 |
| Dialkylbenzolcarboxylat | 47 |
| Polysiloxan-Fragment (kombinierte Werte)* | 82 |
| Polyoxygenierte ungesättigte Verbindung (möglicherweise Polyester-Fragment) | 38 |
| Mischung | Komb. Konz.
(μg/Einheit) |
| Polyoxygenierte ungesättigte Verbindung (möglicherweise Polyesterfragment) mit unbekannter Koelution | 72 |
| Erucamid | 62 |
| Stickstoffhaltige sauerstoffhaltige ungesättigte Verbindung | 94 |
| Alkenoidsäure/-ester mit koeluierender polyoxygenierter
ungesättigten Verbindung, Polysiloxanfragment und Alkylphenolderivat (möglicherweise Irganox 259) |
|
| Oxygenierte ungesättigte Verbindung (enthält möglicherweise Stickstoff) | 200 |
| Alkansäure/-ester mit koeluierenden Polysiloxanfragmenten | 430 |
| Dehydriertes Irganox 1076 mit koeluierendem Irganox 1076 | 43 |
| Di-Amid enthaltende aliphatische Verbindung mit unbekannter Koelution | 190 |
| Unbekannt**** (n = 7) | 20–850 |
| GC/MS – Gaschromatographie/Massenspektrometrie; LC/MS – Flüssig- chromatographie/Massenspektromie; LC/UV – Flüssigchromatographie/
Ultraviolett; LC/UV-Vis – Flüssigchromatographie/durch UV-Bestrahlung sichtbar; UPLC-MS – Ultrahochleistungsflüssigkeitschromatographie – Massenspektrometrie; NVOC – nichtflüchtige organische Verbindungen; SVOC – halbflüchtige organische Verbindungen *Der gemeldete Wert entspricht der Nachweisgrenze von 30 μg/Prüfartikel, wobei oberhalb der Nachweisgrenze kein Vorhandensein der Verbindung festgestellt wurde. **Der gemeldete Wert entspricht der Quantifizierungsgrenze von 20 μg/Prüfartikel, wobei oberhalb der Quantifizierungsgrenze kein Vorhandensein der Verbindung festgestellt wurde. ***Die Konzentrationen der gleichen Verbindung wurden zusammengezählt, wenngleich die Retentionszeit unterschiedlich war. ****Die Werte stellen den Bereich dar, in dem die Mengen aller unbekannten Substanzen festgestellt wurden. |
|
Hinweis: Die angegebenen Werte beziehen sich auf das Lösungsmittel, das eine höhere Konzentration der Verbindung aufwies. Es wurden keine flüchtigen Verbindungen festgestellt.
Quantifizierung von in konzentrierter Salpetersäure aufgeschlossenen auslaugbaren Elementen anhand induktiv gekoppelter Plasma-/Massenspektrometrie (ICP/MS).
| Element | Konzentration (μg/Einheit) |
| Aluminium | < 1,02* |
| Antimon | < 1,02* |
| Arsen | < 1,02* |
| Barium | 0,132 |
| Beryllium | < 1,02* |
| Cadmium | < 1,02* |
| Kalzium | 3,58 |
| Cerium | < 1,02* |
| Caesium | < 1,02* |
| Chrom | 2,94 |
| Kobalt | < 1,02* |
| Kupfer | 1,263 |
| Dysprosium | < 1,02* |
| Erbium | < 1,02* |
| Europium | < 1,02* |
| Gadolin | < 1,02* |
| Gallium | < 1,02* |
| Hafnium | < 1,02* |
| Iridium | < 1,02* |
| Lanthanum | < 1,02* |
| Blei | < 1,02* |
| Magnesium | < 1,02* |
| Mangan | < 1,02* |
| Molybdenum | < 1,02* |
| Nickel | < 1,02* |
| Niobium | < 1,02* |
| Neodymium | < 1,02* |
| Osmium | < 1,02* |
| Platin | < 1,02* |
| Praseodymium | < 1,02* |
| Kalium | 4,77 |
| Rhenium | < 1,02* |
| Rubidium | < 1,02* |
| Ruthenium | < 1,02* |
| Samarium | < 1,02* |
| Selen | < 1,02* |
| Natrium | 92,1 |
| Strontium | < 1,02* |
| Tantalum | < 1,02* |
| Zinn | < 1,02* |
| Titan | 12,42 |
| Tellurium | < 1,02* |
| Thallium | < 1,02* |
| Thorium | < 1,02* |
| Tungsten | < 1,02* |
| Uran | < 1,02* |
| Vanadium | < 1,02* |
| Ytterbium | < 1,02* |
| Zink | 4,34 |
| Zirconium | < 1,02* |
| *Der gemeldete Wert entspricht der Quantifizierungsgrenze von 1,02 μg/Prüfartikel, wobei oberhalb der Quantifizierungsgrenze kein Vorhandensein der Verbindung festgestellt wurde.
|
|
Hinweis: Die angegebenen Werte beziehen sich auf das Lösungsmittel, das eine höhere Konzentration der Verbindung aufwies.
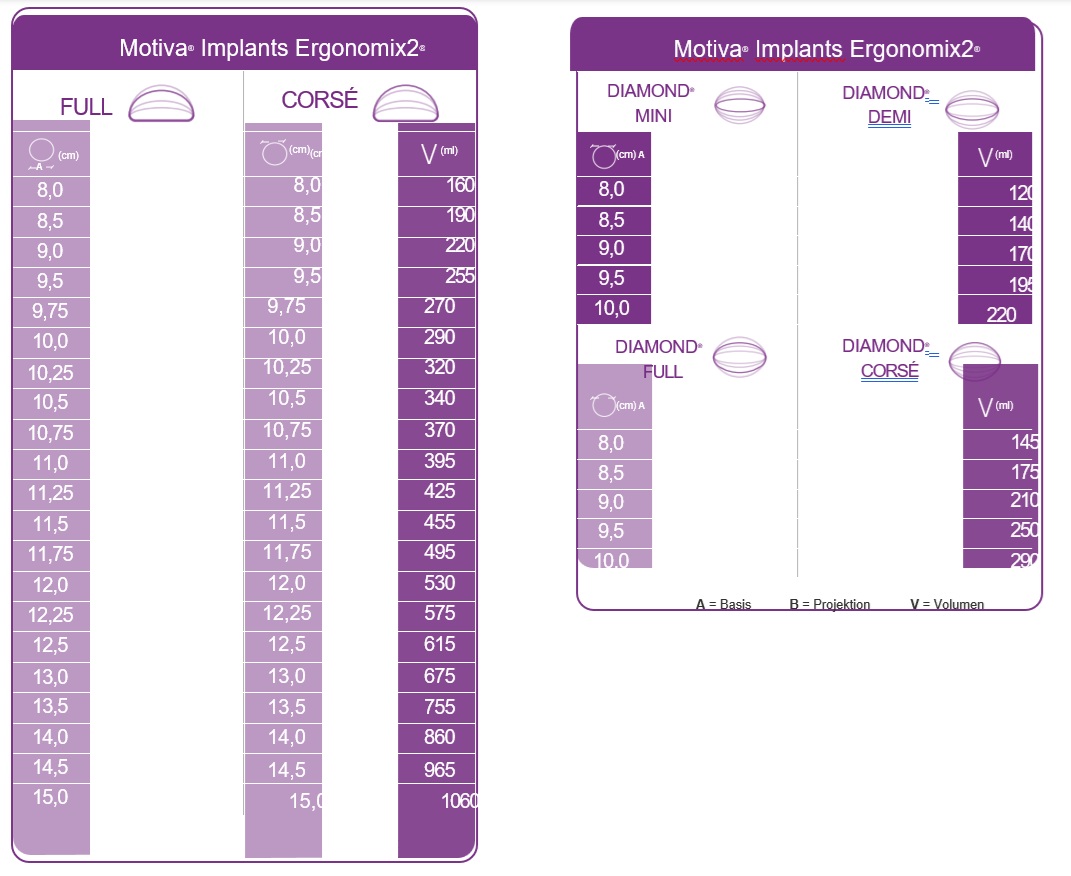
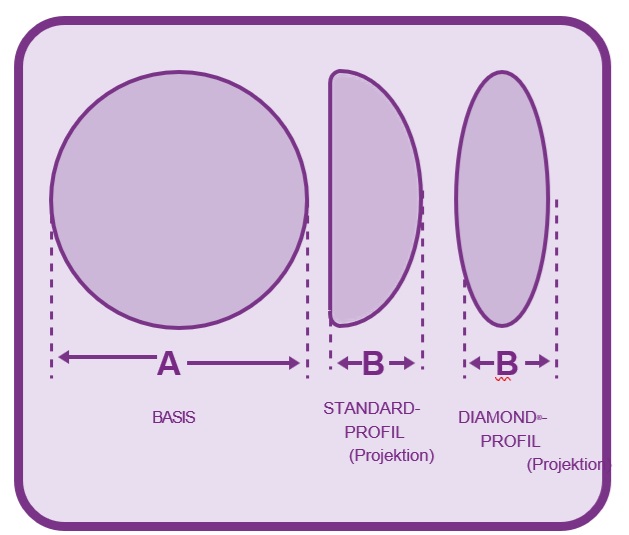
Nachfolgend sind die Referenzbereiche der Motiva Implants® Ergonomix2® sterilen Brustimplantate aus
Silikon von Establishment Labs aufgeführt. Die Implantate sind in zwei Profilausführungen verfügbar:
Standard und Diamond.
V = Volumen B = Projektion
BEDINGUNGEN FÜR DIE BESTIMMUNGSGEMÄSSE VERWENDUNG
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon dürfen nur von in ihrem Land ordnungsgemäß approbierten Ärzten/Chirurgen, die eine qualifizierte Schulung in Brustim- plantationsverfahren absolviert haben, unter sterilen Bedingungen und unter Beachtung guter aseptischer Praktiken verwendet werden.
VORGESEHENE PATIENTINNEN
Motiva Implants Ergonomix2® sterile Brustimplantate aus Silikon sind für Frauen ab 18 Jahren vorgesehen.
ERWARTETER KLINISCHER NUTZEN
Von Motiva Implants® Ergonomix2® sterilen Brustimplantaten aus Silikon werden die folgenden Nutzen erwartet:
- Brustrekonstruktion zum Ersatz von Brustgewebe, das aufgrund von Krebs oder eines Traumas entfernt wurde oder sich aufgrund einer schweren Brustanomalie nicht richtig entwickelt hat, oder
- Revisionsverfahren zur Korrektur oder Verbesserung der Ergebnisse einer früheren operativen Brustrekonstruktion
KONTRAINDIKATIONEN
Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon von Establishment Labs sind kontraindiziert bei:
- Frauen mit Brustkrebs ohne Mastektomie
- Frauen mit aktiven Infektionen
- Schwangeren oder stillenden Müttern
- Frauen mit nicht eingestelltem Diabetes, was medizinisch bekanntermaßen die Wundheilungsfähigkeit beeinträchtigt
- Frauen, deren Gewebeeigenschaften klinisch nicht mit einer Mammaplastik vereinbar sind, wie z. B. Gewebeschädigung aufgrund von beeinträchtigter Durchblutung oder Ulzerationen
- Frauen mit einem Gesundheitszustand – oder einer Behandlung – der/die nach Ansicht des Chirurgen ein unvertretbares chirurgisches Risiko darstellt (z. B. instabile kardiovaskuläre Erkrankung, Koagulopathien, chronische Lungenprobleme usw.)
WARNHINWEISE
Beim Einführen des Implantats im Rahmen des chirurgischen Eingriffs und bei den nachfolgenden Prozeduren sind folgende Vorsichtsmaßnahmen zu beachten:
- Bei der Implantation oder sonstigen chirurgischen Eingriffen dürfen keine scharfen Gegenstände wie Skalpelle oder Nadeln mit dem Produkt in Berührung gelangen.
- Das Implantat darf nicht in Jodlösung eingetaucht werden. Wenn Jodlösung in der Implantattasche verwendet wird, muss diese gründlich mit entionisiertem Wasser ausgespült werden, damit keine Lösungsreste in der Tasche verbleiben.
- Das Implantat darf nicht mit Kauterisationsgeräten in Berührung kommen.
- Das Implantat nicht verändern oder den Versuch unternehmen, ein beschädigtes Implantat zu reparieren oder einzusetzen.
- Beim Einsetzen des Produkts durch die Inzision muss sichergestellt werden, dass keine übermäßige Kraft auf einen sehr kleinen Hüllenbereich ausgeübt wird. Stattdessen sollte die Kraft während des Einsetzens über einen möglichst großen Bereich des Implantats ausgeübt werden. Übermäßiger Kraftaufwand kann zu einer Beschädigung des Implantats führen, entweder durch Gelriss oder Implantatruptur.
- Zum Platzieren des Implantats keinen periumbilikalen Zugang verwenden.
- Nicht mehr als ein Implantat pro Brusttasche einsetzen.
- Eine Kapselkontraktur darf nicht durch eine geschlossene Kapsulotomie oder durch starke Druckausübung von außen behandelt werden, da dies wahrscheinlich eine Beschädigung des Implantats, eine Ruptur, Faltenbildung und/oder ein Hämatom hervorruft.
- Ein zuvor implantiertes Produkt nicht wiederverwenden oder resterilisieren. Brustimplantate sind nur für die einmalige Verwendung bestimmt. Die Nichtbeachtung dieser Indikation kann Infektionen, Serome, Kapselkontrakturen, Reoperationen, unbefriedigende ästhetische Ergebnisse und sonstige, die Gesundheit der Patientin gefährdende unerwünschte Wirkungen zur Folge haben.
- Bei Patientinnen mit Brustimplantaten darf keine Mikrowellendiathermie angewendet werden, da sie mit Gewebenekrose, Hauterosion und Implantatextrusion in Verbindung gebracht wurde.
VORSICHTSHINWEISE
-
Spezifische Populationen
Es liegen keine Ergebnisse zur Sicherheit und Wirksamkeit einer Brustoperation bei den folgenden Populationen und/oder Gegebenheiten vor*:
- Patientinnen mit Autoimmunerkrankungen (z. B. Lupus, Sklerodermie),
- Patientinnen mit einem geschwächten Immunsystem (z. B. solche, die zurzeit eine immunsuppressive Therapie wie Steroide erhalten),
- Patientinnen mit Erkrankungen oder Medikamenten, welche die Wundheilungsfähigkeit (z. B. schlecht eingestellter Diabetes oder Kortikosteroidtherapie) oder die Blutgerinnung (z. B. gleichzeitige Warfarintherapie) beeinträchtigen können,
- Patientinnen mit eingeschränkter Durchblutung der Brust oder des darüber liegenden Gewebes,
- Patientinnen, die sich einer Strahlentherapie unterziehen,
- Frauen mit Schlauchbrüsten, bei denen die Brustwarzen unter die Unterbrustfalte fallen, ohne gleichzeitige Mastopexie,
- Frühere, wiederholt fehlgeschlagene Konturenkorrekturen,
- Patientinnen mit klinisch diagnostizierter Depression oder einer sonstigen psychischen Störung, einschließlich körperdysmorpher Störung und Essstörungen. (Die Patientin sollte darauf hingewiesen werden, vor der Operation mit ihrem Chirurgen über etwaige psychische Störungen in der Vorgeschichte zu sprechen. Patientinnen mit einer diagnostizierten Depression oder sonstigen psychischen Störungen sollten mit einer Operation zum Einsetzen eines Brustimplantats warten, bis sich dieser Zustand stabilisiert hat.)
*Bei anderen Patientinnen mit einer komplizierten medizinischen Vorgeschichte kann davon ausgegangen werden, dass Risikofaktoren bestehen, welche die Sicherheit und Wirksamkeit der Brustimplantatoperation beeinflussen könnten. Wie bei jedem chirurgischen Eingriff muss die Krankengeschichte der Patientin sorgfältig geprüft werden, um sicherzustellen, dass sie eine geeignete Kandidatin für eine Brustimplantatoperation ist.
-
Vorsichtshinweise für die Operation
Vorab-Inspektion des Produkts: Das Produkt unmittelbar vor dem Einsetzen durch vorsichtiges Bewegen auf Ruptur, Gelriss, undichte Stellen oder Verunreinigungen durch Partikel untersuchen.
Operationstechnik und Implantatauswahl: Für die Implantation eines silikongelgefüllten Brustimplantats können mehrere Operationstechniken angewendet werden. Dem Chirurgen wird daher empfohlen, anhand seines klinischen Urteilsvermögens die beste Lösung für die Patientin gemäß dieser Produktbeilage auszuwählen:
- Die Inzision sollte ausreichend lang sein, um das Volumen und Profil des Implantats aufzunehmen und so die Gefahr einer übermäßigen Belastung des Implantats beim Einsetzen zu verringern. Das Forcieren von Implantaten durch eine sehr kleine Öffnung kann zu einer lokalen Schwächung der Hülle des Brustimplantats führen, was eine Beschädigung der Hülle, einen Gelriss und möglicherweise eine Ruptur des Implantats zur Folge haben kann. Nach dem Setzen realistischer ästhetischer Ziele, die ein gegenseitiges Einvernehmen zwischen Arzt und Patientin gewährleisten, muss der Chirurg aus den aktuellen, anerkannten Operationstechniken diejenige Technik auswählen, welche die Inzidenz unerwünschter Reaktionen minimiert und die besten Ergebnisse erzielt.
- Beim Einsetzen des Produkts ist eine Falten- oder Furchenbildung zu vermeiden. Es wird empfohlen, vor dem Verschließen mit einem Finger um das Implantat herumzufahren, um sicherzustellen, dass das Implantat flach liegt.
- Verfahren wie offene Kapsulotomie, Brusttaschenrevision, Hämatom-/Seromaspiration, Biopsie und Lumpektomie können eine Beschädigung der Implantathülle zur Folge haben und müssen daher mit Vorsicht durchgeführt werden. Bei einer Neupositionierung des Implantats bei späteren Eingriffen ist Vorsicht geboten, um eine Kontamination des Implantats zu vermeiden.
- Periareoläre und axilläre Inzisionsstellen können das Einsetzen erschweren und das Risiko einer Beschädigung des Implantats erhöhen. Die periareoläre Inzision kann die zukünftige Stillfähigkeit der Patientin erheblich reduzieren.
- Die Implantatgröße sollte sich an den Brustwandabmessungen der Patientin orientieren, einschließlich der Basisbreite, der Eigenschaften des Gewebes und der Implantatprojektion.
- Texturierte Implantate, größere Implantate, subglanduläre Platzierung und eine zu geringe das Implantat bedeckende Gewebemenge können dazu führen, dass ein Implantat stärker tastbar ist.
- Größere Implantate können das Risiko von Komplikationen wie Extrusion, Hämatom, Infektionen, tastbaren Implantatfalten und sichtbarer Hautfaltenbildung erhöhen.
RELEVANTE THEMEN, DIE MIT DER PATIENTIN BESPROCHEN WERDEN MÜSSEN
Hinweise zur Patientenaufklärung
Bevor eine Patientin zu Motiva Implants® Ergonomix2® sterilen Brustimplantaten aus Silikon und die Brustoperation beraten wird, müssen das vorliegende Dokument und die Informationen für die Patientin genau gelesen werden. Ärzte müssen den Inhalt dieser Dokumente aufmerksam durchlesen und verstehen und sicherstellen, dass alle Fragen oder Bedenken der Patientin vor der Anwendung des Produkts geklärt wurden. Die Brustimplantat-Operation ist ein elektives Verfahren, und die Patientin muss die potenziellen Risiken und Nutzen verstehen, um eine informierte Entscheidung zu treffen. Aus diesem Grund muss die Patientin angewiesen werden, das Dokument mit dem Titel „Informationen für die Patientin – Brustvergrößerung und -rekonstruktion mit Motiva Implants®“ zu lesen, welches auf der Website https://ifu.motiva.health/ verfügbar ist. Der Arzt muss mit der Patientin die Abschnitte zu Warnhinweisen, Kontraindikationen, Vorsichtsmaßnahmen, zu berücksichtigende wichtige Faktoren, Komplikationen und alle anderen im Dokument genannten Aspekte besprechen. Der Arzt muss die Patientin über die möglichen Komplikationen aufklären und darauf hinweisen, dass die medizinische Behandlung schwerwiegender Komplikationen zusätzliche Operationen und eine Explantation umfassen kann.
PATIENTINNENINFORMATION UND EINWILLIGUNGSERKLÄRUNG
Der Chirurg ist dafür verantwortlich, die Einwilligung der Patientinnen durch einen erfolgreich durchgeführten Informations- und Entscheidungsprozess zu dokumentieren, was anhand des Informations- und Einwilligungsformular erfolgt. Das Formular muss vom Chirurgen, der Patientin und einem Zeugen unterzeichnet werden und wird in die Krankenakte der Patientin aufgenommen. Patientinnen, die eine Operation zur Implantation eines Brustimplantats in Erwägung ziehen, müssen über alle potenziellen Nebenwirkungen und Komplikationen im Zusammenhang mit dem Eingriff aufgeklärt werden.
In Ergänzung des Prozesses der Patientinnenaufklärung und Einwilligung empfiehlt Establishment Labs, der Patientin im Rahmen der chirurgischen Konsultation das Dokument mit dem Titel „Informationen für die Patientin – Brustvergrößerung und -rekonstruktion mit Motiva Implants®“ auszuhändigen, welches auf der Website https://ifu.motiva.health/ heruntergeladen werden kann. Establishment Labs vertraut darauf, dass jeder Chirurg seiner Verantwortung nachkommt, jeder Patientin ausreichend Zeit zu geben, die Risiken, Nutzen und Empfehlungen im Zusammenhang mit einem Brustimplantat zu lesen und zu verstehen, um eine informierte Entscheidung zu treffen.
Kurzbericht über Sicherheit und klinische Leistung (SSCP) für die Europäische Gemeinschaft
Zusätzliche und aktualisierte Informationen zum Produkt Motiva Implants® Ergonomix2® können im Kurzbericht über Sicherheit und klinische Leistung (SSCP) nachgelesen werden, der auf der Website des Unternehmens unter https://ifu.motiva.health/ und auf der EUDAMED-Website unter https://ec.europa.eu/tools/eudamed anhand der UDI-DI-Teilenummer eingesehen werden kann.
Vermeidung von Schäden während der Behandlung
Die Patientinnen müssen andere behandelnde Ärzte über das Vorhandensein der Implantate informieren, um die Gefahr einer Beschädigung zu minimieren.
Psychische Gesundheit und elektive Operationen
Alle Patientinnen, die sich für einen elektiven brustchirurgischen Eingriff entscheiden, müssen realistische Erwartungen haben, die auf eine Verbesserung und nicht auf Perfektion ausgerichtet sind. Bitten Sie die Patientin, vor der Operation offen über Depressionen oder andere psychische Störungen zu sprechen.
Methoden zur Untersuchung der Brust
Die Patientinnen sollten monatlich eine Selbstuntersuchung der Brust durchführen und sich zeigen lassen, wie sie das Implantat von ihrem Brustgewebe unterscheiden können. Die Patientin sollte das Implantat nicht zu stark manipulieren oder zusammendrücken. Die Patientin ist darauf hinzuweisen, dass Knoten, anhaltende Schmerzen, Schwellungen, Verhärtungen oder Veränderungen der Implantatform auf eine symptomatische Ruptur des Implantats hindeuten könnten.
Postoperative Versorgung
Die Patientin ist darauf hinzuweisen, dass sie sich nach der Operation für einige Tage müde und wund fühlen kann; die Brüste können noch einen Monat lang oder länger geschwollen und berührungsempfindlich sein. Es kann auch zu einem Spannungsgefühl im Brustbereich kommen, da sich die Haut an die neue Brustgröße anpasst. Die Patientin sollte mindestens einige Wochen lang keine anstrengenden Tätigkeiten ausüben, sollten aber innerhalb weniger Tage wieder an ihren Arbeitsplatz zurückkehren können. Bei Bedarf kann auch eine Brustmassage empfohlen werden. Die Patientin sollte etwaige Probleme sofort melden und eventuell eine MRT-Untersuchung durchführen lassen, um eine Ruptur auszuschließen.
Metalldetektoren
An manchen Flughäfen können Motiva Implants® mit Mikrotransponder durch hochempfindliche Metalldetektoren erkannt werden.
Topische Arzneimittel – Vor der Anwendung topischer Arzneimittel (z. B. Steroide) im Brustbereich sollte die Patientin einen Arzt oder Apotheker konsultieren.
Rauchen – Rauchen kann sich negativ auf den Heilungsprozess auswirken.
Strahlentherapie der Brust – Aus der Literatur geht hervor, dass eine Strahlentherapie die Wahrscheinlichkeit einer Kapselkontraktur, Nekrose und Extrusion des Implantats erhöhen kann.
Übernahme durch die Versicherung – Die Patientinnen sollten sich vor der Operation bei ihrer Krankenversicherung über die Kostenübernahme informieren.
OP-Umgebung und Anästhesie – Eine Brustimplantatoperation wird in einem spezialisierten Operationssaal in einer Klinik/einem Krankenhaus durchgeführt. In der Regel wird der Eingriff unter Allgemeinanästhesie durchgeführt, aber auch eine Lokalanästhesie mit Sedierung kommt in Frage. Die Patientin muss sich bei ihrem Chirurgen und bei der Einrichtung, in der die Operation durchgeführt wird, bezüglich der Tests, der präoperativen Untersuchungen und der Zeit, die sie vor dem chirurgischen Eingriff nüchtern bleiben muss, erkundigen und in Erfahrung bringen, welche Routine-Medikamente eingenommen werden dürfen.
MÖGLICHE NEBENWIRKUNGEN
Falls eines der folgenden unerwünschten Ereignisse oder sonstige Ereignisse auftreten, füllen Sie bitte ein Meldeformular für Beschwerden aus, das alle verfügbaren Informationen zur Patientin, zum Produkt, einen Grund für die Beschwerde und eine Zusammenfassung des Ereignisses enthält, und senden Sie es an motiva.health/patients-support/.
Da brustchirurgische Eingriffe zum Einsetzen eines Implantats meist unter Allgemeinanästhesie erfolgen, gehen sie mit den gleichen Risiken wie andere invasive chirurgische Verfahren einher. In den ersten Wochen nach der Brust-OP können Schwellungen, Verhärtungen, Unwohlsein, Juckreiz, Blutergüsse, Stechen und Schmerzen auftreten. Die festgestellten unerwünschten Nebenwirkungen sind im Folgenden aufgeführt.
Entzündung/Reizung – Brustimplantate unterscheiden sich nicht von anderen in den menschlichen Körper implantierten Fremdkörpern und können eine schützende Immunantwort des Körpers auslösen. Dabei handelt es sich um eine Fremdkörperreaktion, die sich durch Rötung, Schwellung, Wärme, Schmerzen und/oder Funktionsverlust manifestiert.
Diese Fremdkörperreaktion ist universell. Im Idealfall entfernt sie das „reizverursachende Material“ oder umgibt es auf andere Weise mit fibrösem Gewebe, um unerwünschte Folgen für das Immunsystem zu verhindern.
Gelriss – Gelrisse sind definiert als Fissuren oder Risse im Gel des Implantats, die auftreten, wenn das Silikon-Füllmaterial durch übermäßige intrinsische Kräfte sehr heftig beansprucht wird. Dies führt dazu, dass die Form des Implantats unwiderruflich verloren geht und das Implantat ersetzt werden muss. Gelrisse können bei Implantaten mit kohäsivem Silikon auftreten und entstehen meist infolge übermäßiger, auf einen kleinen Bereich der Hülle einwirkender Kompressionskräfte während des Einsetzens des Implantats. Ein Gelriss kann auch durch die Entwicklung einer Kapselkontraktur entstehen und eine Deformation des Produkts zur Folge haben.
Die Inzision sollte ausreichend lang sein, um das Volumen und Profil des hochkohäsiven Gelimplantats aufnehmen zu können. Dadurch wird die Gefahr einer übermäßigen Belastung verringert, welche das Gel des Implantats beschädigen und potenziell zu einer Implantatruptur oder einem Gelriss führen kann.
Gelrisse lassen sich mithilfe von Ultraschall oder Magnetresonanztomographie (MRT) feststellen. Die meisten Gelrisse sind durch eine körperliche Untersuchung nicht feststellbar.
Geldiffusion – Geringe Mengen an Silikon können durch die Elastomerhülle aus den mit Silikongel gefüllten Implantaten diffundieren/austreten. In der Literatur wurde bei Patientinnen mit scheinbar intakten gelgefüllten Implantaten über den Nachweis geringer Silikonmengen in der periprothetischen Kapsel, den Achsellymphknoten und in anderen distalen Regionen berichtet. In manchen Studien zu Langzeitimplantaten wurde die Vermutung geäußert, dass das Austreten von Gel zur Entwicklung einer Kapselkontraktur und Lymphadenopathie beitragen kann. Andererseits spricht die Evidenzlage dagegen, dass das Austreten von Gel ein wesentlicher beitragender Faktor einer Kapselkontraktur ist. Andere lokale Komplikationen werden genannt, selbst wenn die Komplikationsraten bei mit Silikongel gefüllten Brustimplantaten ähnlich hoch oder niedriger sind als bei salzgefüllten Brustimplantaten.1
Rötung/Blutergüsse – Blutungen während der Operation können zu einer Verfärbung der Haut führen. Es handelt sich um ein zu erwartendes, operationsbedingtes Symptom, das wahrscheinlich vorübergehend ist.
Unbefriedigende Ergebnisse/kosmetischer Defekt – Unbefriedigende Ergebnisse wie Dehnungsstreifen, Sichtbarkeit und Unzufriedenheit mit dem Implantatvolumen sind möglich. Manche dieser Ergebnisse können physische Beschwerden verursachen. Eine vorbestehende Asymmetrie lässt sich durch eine Implantatoperation möglicherweise nicht vollständig korrigieren. Um die Patientenzufriedenheit zu erhöhen, könnte ein Revisionseingriff angezeigt sein, wobei zusätzliche Überlegungen und Risiken zum Tragen kommen. Eine sorgfältige präoperative Planung und Operations- technik können zwar unbefriedigende Ergebnisse minimieren, aber nicht immer verhindern.
Schmerzen – Die meisten Frauen, die sich einer Brustimplantatoperation unterziehen, haben nach der Operation Schmerzen in der Brust und/oder im Brustbereich. Während diese Schmerzen bei den meisten Frauen im Heilungsverlauf zurückgehen, können sie bei anderen Frauen zu einem chronischen Problem werden. Hämatom, Migration, Infektion, zu große Implantate oder eine Kapselkontraktur können chronische Schmerzen verursachen. Plötzliche, starke Schmerzen können mit einer Implantatruptur verbunden sein. Der Chirurg muss die Patientin anweisen, starke oder anhaltende Schmerzen umgehend zu melden.
Hautausschlag/Silikonreaktion/Allergie – Die Hautrisiken bei Brustimplantaten scheinen im Allgemeinen gering zu sein. In verschiedenen Berichten wurde jedoch das Auftreten kutaner Überempfindlichkeitsreaktionen auf Brustimplantate dokumentiert – trotz deren biologischer Verträglichkeit und der angenommenen Inertheit ihrer Verbindungen. Topische und systemische Medikamente können möglicherweise Linderung bewirken und zu einem erfolgreichen Abklingen der Symptome führen. In manchen Fällen muss das Implantat entfernt werden, um eine vollständige Beseitigung der Symptome zu erreichen.
Schwellung – Die normale postoperative Schwellung, die etwa drei bis fünf Tage nach der Operation ihren Höhepunkt erreicht, verstärkt das Druckgefühl in der Brust. Es handelt sich um eine natürliche Reaktion des Körpers auf das Operationstrauma.
Laktationsschwierigkeiten – Frauen, die sich einer Mastektomie und anschließend einer Rekonstruktion mit einem Brustimplantat unterziehen, können auf der betroffenen Seite möglicherweise nicht mehr stillen, da das Brustgewebe und die milchproduzierenden Drüsen verlorengehen.
Wärmeempfindung – Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon, die mit einem Mikrotransponder ausgestattet sind, können während einer MRT-Untersuchung unter definierten Bedingungen eine minimale Wärmeempfindung auslösen.
Hypertrophe Narben – Narbenbildung ist ein natürlicher Heilungsprozess, und es kann einige Zeit dauern, bis Verbesserungen sichtbar werden. Hypertrophe Narben können entstehen, wenn es zu einer übermäßigen Produktion von Narbengewebe kommt. Narben können auch entstehen, weil die Wundheilung zu lange dauert. Biologisch gesehen sind manche Menschen aufgrund ihrer genetischen Veranlagung anfälliger für hypertrophe Narben.2
Bottoming-Out – Dies bezieht sich auf das Verrutschen eines Brustimplantats nach unten, wodurch sich der Abstand zwischen dem Brustwarzen-Areolar-Komplex und der Inframammärfalte (IMF) nach einer Brustimplantatoperation vergrößert. Zu den in der Literatur berichteten Risikofaktoren gehören u. a. die mangelnde Qualität des vorbestehenden Brustgewebes (d. h. dünnes Unterhautgewebe, defekte dermale Elemente und Schlauchbrust), die Eigenschaften des gewählten Brustimplantats (z. B. zu groß), die IMF-Präparation und die Art der Implantatplatzierung während der Operation (d. h. submuskuläre und subglanduläre Ebenen).3
Zu den klinischen Symptomen eines nach unten verrutschten Implantats gehören Asymmetrie, nach oben gerichtete Brustwarzen, Erschlaffung, Tastbarkeit usw. Durch eine angemessene OP-Planung lassen sich die möglichen Ursachen dafür minimieren. Empfohlen werden unter anderem eine sorgfältige Beurteilung des individuellen Brustgewebes, eine sorgfältige Auswahl des Implantats, die Anwendung risikominimierender Operationstechniken und eine angemessene Stützung der Brust nach der Operation. Die Behandlungen können je nach Schwere der Komplikation variieren und reichen von einer einfachen submammären Fixierung bis hin zur Verwendung zusätzlicher stützender Materialien.
Verzögerte Wundheilung – Bei manchen Patientinnen kann die Wundheilung länger dauern. Rauchen verringert den Sauerstoffgehalt des Bluts, was sich direkt auf den Heilungsprozess der Operationswunden auswirkt. Ja nach Art des Operation oder Inzision kann eine verzögerte Wundheilung das Risiko einer Infektion, Extrusion und Nekrose erhöhen.
Kapselkontraktur – Eine Kapselkontraktur bezeichnet hypertrophes Narbengewebe, das einen Fremdkörper oder ein chirurgisch implantiertes Produkt umgibt und das ästhetische Resultat beeinträchtigt, was zu Schmerzen und einer Verformung der Brust führt und häufig weitere Operationen erforderlich macht.4 Auch die Erkennung von Brustkrebs durch Mammographie kann sich als Herausforderung erweisen. Eine Kapselkontraktur kann nach einer Infektion, einem Hämatom oder Serom häufiger auftreten, und ihre Auftretenswahrscheinlichkeit kann mit der Zeit zunehmen. Eine Kapselkontraktur tritt bei Patientinnen, die sich einer Revisionsoperation unterziehen, häufiger auf als bei einer Erstimplantation. Eine Kapselkontraktur ist die häufigste Komplikation nach einem implantatbasierten brustchirurgischen Eingriff und einer der häufigsten Gründe für eine Reoperation.
Die Kapselkontraktur wird je nach Schweregrad in vier Stufen eingeteilt:
- Baker-Grad I: Die Brust ist normal weich und sieht natürlich aus.
- Baker-Grad II: Die Brust fühlt sich etwas fester an, sieht aber normal aus.
• Baker-Grad III: Die Brust fühlt sich fest an und ihre Form wirkt unnatürlich.
• Baker-Grad IV: Die Brust ist hart, schmerzhaft und wirkt unnatürlich.
Die Patientinnen müssen auch darüber aufgeklärt werden, dass bei starken Schmerzen und/oder Beschwerden (d. h. bei einem Baker-Grad III oder IV) eine zusätzliche Operation erforderlich sein und die Kapselkontraktur nach weiteren Operationen erneut auftreten kann.
Eine geschlossene Kapsulotomie (d. h. eine externe Manipulation der Kapsel, um die Gewebekapsel zu „sprengen“ und sie zu öffnen) ist ein gängiges Verfahren zur Behandlung der Kapselkontraktur. Die meisten Hersteller, so auch Establishment Labs, raten jedoch davon ab, da sie eine Ruptur des Implantats verursachen kann.
Infektionen – Bei jedem chirurgischen Eingriff oder Implantat können Infektionen auftreten. Die meisten operationsbedingten Infektionen treten innerhalb weniger Tage bis Wochen nach der Operation auf.5 Das Auftreten einer Infektion ist jedoch zu jedem Zeitpunkt nach der Operation möglich. Zusätzlich kann das Infektionsrisiko durch Brust- und Brustwarzenpiercings erhöht werden. Infektionen in Gewebe mit einem Implantat sind schwieriger zu behandeln als Infektionen in Gewebe ohne Implantat. Wenn eine Infektion nicht auf Antibiotika anspricht, muss das Implantat möglicherweise entfernt werden. Ein neues Implantat kann erst nach Abklingen der Infektion eingesetzt werden.
Wie bei anderen chirurgischen Eingriffen wurden auch nach brustchirurgischen Eingriffen zum Einsetzen eines Implantats seltene Fälle eines lebensbedrohlichen toxischen Schocksyndroms (TSS) berichtet. TSS-Symptome treten plötzlich auf und können hohes Fieber (38,8 °C/102 °F oder höher), Erbrechen, Durchfall, Ohnmacht, Schwindel und/oder einen sonnenbrandartigen Ausschlag umfassen. Die Patientinnen sollten bei Auftreten dieser Symptome umgehend ihren Arzt verständigen.6
Serom – Ein Serom ist eine Flüssigkeitsansammlung, die durch eine Entzündung von Gewebe entsteht.7 Die Ätiologie des Seroms in der Brustchirurgie ist bekannt. Sie steht im Zusammenhang mit einem hypovaskulären Milieu oder einem nach der Operation erlittenen Trauma.
Häufig werden Serome über mehrere Wochen hinweg vom Körper resorbiert, mitunter ist aber auch eine Nadeldrainage zum Entfernen der Flüssigkeit erforderlich.8 Serome erhöhen zwar nicht das Brustkrebsrisiko, doch heilen sie manchmal unter Bildung von Narbengewebe oder Verkalkungen ab, die bei künftigen Mammographien Anlass zur Sorge geben können. Serom-Symptome treten meist eine Woche bis 10 Tage nach der Operation auf. Der Bereich kann sich empfindlich anfühlen und geschwollen sein und innerhalb von ein oder zwei Tagen kann es zu einer diskreten Knotenbildung und Rötung kommen. Eine frühe Serombildung ist definiert als periprothetische Flüssigkeitsansammlung innerhalb des ersten postoperativen Jahres, während die späte Form zu jedem Zeitpunkt danach auftreten kann.9
Ein Serom verursacht nicht nur Schmerzen, sondern erhöht auch das Risiko einer Infektion in der Brust. Je nach Lage kann sie auch den Druck auf die Operationsstelle erhöhen und gelegentlich eine Wunddehiszenz verursachen.
Hämatom – Ein Hämatom ist eine Blutansammlung im Brustgewebe. Hämatome sind eine von mehreren Komplikationen, die nach einer Brustimplantatoperation auftreten können. Symptome eines Hämatoms sind gewöhnlich Schwellungen, Blutergüsse und Schmerzen im Bereich der Inzision.10 Zwar sind die meisten Hämatome klein, klingen von selbst vollständig ab und werden vom Körper resorbiert, doch sollten Patientinnen, die mittelstarke bis starke Schmerzen haben, im Rahmen eines Nachbetreuungstermins untersucht werden. Die meisten Hämatome bilden sich entweder von selbst zurück oder brauchen lediglich drainiert zu werden. Drainagen sind kleine chirurgische Schläuche, die aus der Brust herausführen und an denen ein kleiner Balg sitzt, um Blut und andere Flüssigkeiten aufzufangen.
Ruptur – Ein Brustimplantat rupturiert, wenn die Hülle reißt oder ein Loch entsteht. Eine Ruptur kann zu jedem Zeitpunkt nach der Implantation auftreten, ist aber umso wahrscheinlicher, je länger das Implantat eingesetzt ist. Folgende Ursachen können zum Rupturieren von Implantaten führen: Beschädigung durch chirurgische Instrumente, Belastung und Schwächung des Implantats während der Implantation, Alter und Design des Implantats, submuskuläre statt subglanduläre Lage, postoperatives Auftreten von Hämatomen oder Seromen, Falten- oder Furchenbildung in der Implantathülle, übermäßige Krafteinwirkung auf den Brustkorb, Trauma, Kompression im Rahmen der Mammographie und schwere Kapselkontraktur.11
Wenn mit Silikongel gefüllte Implantate reißen, handelt es sich meist um eine „stille Ruptur“, was bedeutet, dass weder der Arzt noch die Patientin bei der körperlichen Untersuchung feststellen können, ob das Implantat einen Riss oder ein Loch in der Hülle hat. Verschiedene Techniken können herangezogen werden, um die Unversehrtheit von Brustimplantaten (und die Erkennung von Gelrissen und/oder stillen Rupturen) zu prüfen. Hochauflösender Ultraschall (HRUS) ist ein von medizinischen Fachkräften und Patienten zur Rupturdiagnose allgemein akzeptiertes Verfahren. Zusätzlich empfiehlt die USFDA eine Überwachung mittels Magnetresonanztomographie (MRT), wobei die erste MRT drei Jahre nach dem Eingriff und danach alle zwei Jahre durchgeführt werden sollte.12 Diese Empfehlungen können von Land zu Land unterschiedlich sein. Bitte geben Sie der Patientin daher zusätzliche Orientierungshilfe unter Berücksichtigung des in Ihrem Land aktuell geltenden Versorgungsstandards. Eine geschlossene Kapsulotomie wird von Establishment Labs zur Behandlung einer Kapselkontraktur nicht empfohlen, da sie eine Implantatruptur verursachen kann.
Es können verschiedene Symptome auftreten, z. B. Knoten um das Implantat herum oder in der Achselhöhle, Veränderung oder Verlust der Größe oder Form der Brust oder des Implantats, Schmerzen, Kribbeln, Schwellung, Taubheit, Brennen oder Verhärtung der Brust. Diese Symptome sind nicht spezifisch für eine Ruptur und können auch bei Patientinnen mit Kapselkontraktur auftreten.
Es wurden einige Fälle berichtet, die darauf hindeuten, dass das Auslaufen von Silikonimplantaten im Rahmen der Differentialdiagnose einer Eosinophilie erwogen werden sollte.13
Extrusion – Zu einer Extrusion oder Freilegung des Brustimplantats kommt es, wenn die Haut und das Brustgewebe, die das Implantat halten, versagen, sodass das Implantat durch die Haut ragt und freigelegt wird. Dies geschieht bei weniger als 2 % der Patientinnen und kann kurz nach der Brustimplantatoperation oder im weiteren Verlauf auftreten. Zu einer Brustimplantat-Extrusion kann es aus verschiedenen Gründen kommen, z. B. durch infektionsbedingt unzureichende Wundheilung, Trauma, nicht ausreichende Abdeckung mit Weichgewebe, zu große Implantatgröße in Verbindung mit zu geringer Gewebeabdeckung oder mangelnde Blutversorgung. Bei einer Brustimplantat-Extrusion muss das Implantat operativ entfernt werden.14
Wunddehiszenz – Unter Wunddehiszenz versteht man das Auseinanderweichen der Ränder einer geschlossenen chirurgischen Hautinzision mit oder ohne Exposition oder Protrusion von darunter liegendem Gewebe, Organen oder Implantaten. Das Auseinanderweichen kann in einer einzelnen oder in mehreren Regionen auftreten, die volle Länge der Inzision umfassen und eine oder mehrere Gewebeschichten betreffen. Eine dehiszierte Inzision kann klinische Anzeichen und Symptome einer Infektion aufweisen, muss es aber nicht.
Rotation – Eine anteriore/posteriore Rotation, auch „Flipping“ oder „Verdrehen“ genannt, wurde bei Kohäsivgelimplantaten häufiger beobachtet. Die flache Basis des Implantats weist nach anterior und deformiert die Brust der Patientin. Ordnungsgemäße Platzierung und Taschenpräparation verringern das Auftretensrisiko.15
Flipping lässt sich durch Manipulation mit beiden Händen in der Praxis behandeln und kann bei nochmaligem Auftreten erneut durchgeführt werden. In einigen Fällen kann jedoch eine Revisionsoperation erforderlich sein, um die Abmessungen der Tasche zu reduzieren.
In der Literatur wird berichtet, dass es durch die Wechselwirkung zwischen der Brusthülle, den physikalischen Eigenschaften des Implantats und einer Taschendissektion zu einer Fehllage kommen kann. Andere Theorien sprechen von einer Selbstinversion des Brustgewebes.
In Bezug auf die Merkmale eines Implantats war Flipping mit dem Vorhandensein bzw. Nichtvorhandensein einer Texturierung, der Form/dem Profil des Implantats und dem Gel-Füllungsgrad (d. h. dem Grad der Implantatfüllung) assoziiert. Weitere Faktoren wie Infektion, Hämatom/Serom, Kapselkontraktur, Dissektion, Erfahrung des Chirurgen, körperliche Aktivität und externe Manipulation des Implantats können potenziell zur Entwicklung dieser Komplikation beitragen.
In der Diamond-Projektion besitzt Ergonomix2® eine symmetrische Form mit gleichem Scheitelpunkt auf beiden Seiten. Diese Geometrie könnte aufgrund ihres Designs sichtbare Profilabweichungen im Falle eines „Flippens“ verringern.
Fehllage – Eine Fehllage eines Brustimplantats ist definiert als eine Fehlplatzierung während der Operation oder Verschiebung des Implantats aus seiner ursprünglichen Position. Dies wird auch als Dislokation/Lateralisation bezeichnet. Fehllagen sind aufgrund ihrer multifaktoriellen Ursachen ein häufiges Ereignis, das während der Lebensdauer des Produkts zu erwarten ist.
Die Verschiebung des Implantats kann durch Trauma, Kapselkontraktur, Schwerkraft oder falsche Erstplatzierung verursacht werden.16 Der Chirurg muss die Operation sorgfältig planen und den Eingriff mit einer Technik durchführen, mit der das Risiko einer Fehllage minimiert wird, wenngleich sie nicht komplett ausgeschlossen werden kann. Das mit diesem Ereignis verbundene Risiko besteht in einer Unzufriedenheit mit dem ästhetischen Resultat.
Doppelkapsel – Die Doppelkapsel bezeichnet das Feststellen von zwei unterschiedlichen Kapselschichten um ein Brustimplantat herum, die durch einen Kapselzwischenraum getrennt sind. Wenngleich es sich um ein seltenes Ereignis handelt, kann es nach einer Brustimplantation zu einer Doppelkapsel kommen. Die Ätiopathologie dieser Erscheinung ist noch nicht geklärt. Es gibt aber im Wesentlichen zwei Hypothesen, die die Entwicklung dieser Komplikation erklären könnten. Die erste Hypothese ist die einer mechanischen Delamination der periprothetischen Kapsel, bei der aufgrund von Frakturen nach der Einwirkung von Scherkräften zwischen dem inneren Kapsel-Prothesen-Komplex und der äußeren Kapsel ein Kapselzwischenraum entsteht. Die zweite Hypothese betrifft die Entstehung periprothetischer Serome, die sich um die Kapsel herum entwickeln. Doppelkapseln können partiell oder vollständig ausgeprägt sein. Die klinischen Anzeichen können von asymptomatisch bis hin zu einer Verhärtung des Implantats, Unbehagen, Veränderungen der Form oder Position des Implantats und Schmerzen reichen.
Symmastie – Bei der Symmastie handelt es sich um eine relativ seltene Implantatdislokation, die auftritt, wenn sich die Haut und der Muskel zwischen den Brüsten über dem Brustbein ablösen und die beiden Gewebetaschen, die die Brustimplantate halten, sich zu einer Tasche vereinen. Dadurch können die Implantate in der Mitte zusammentreffen, was zu einem sog. „Uniboob“ führt und mitunter Unbehagen oder Schmerzen verursacht. Die Korrektur einer Symmastie ist häufig schwierig, und es kann mehr als eine Operation erforderlich sein. In den meisten Fällen werden bei der Operation die Implantate entfernt und durch neue (in der Regel kleinere) Implantate ersetzt.
Asymmetrie – Zu den präoperativen Asymmetrien zählen Areolen in unterschiedlich mittigen Positionen oder in unterschiedlicher Höhe, unterschiedliche Brustformen (z. B. die eine Brust ist rund, die andere schlauchförmig) oder auch unterschiedliche Brustgrößen. Diese Arten von Asymmetrien müssen von einer postoperativen ästhetischen Nichtübereinstimmung zwischen den beiden Brüsten unterschieden werden, die durch die zuvor beschriebenen Faktoren verursacht wird, wie z. B. einen Fall der Falte, ein hoch sitzendes Implantat oder eine Drehung des Implantats. Asymmetrien werden durch ungleiche Einpassung des Implantats oder durch die Schaffung unterschiedlicher Inframammärfalten verursacht. Dies lässt sich durch eine angemessene präoperative Planung, eine korrekte Taschenpräparation und den Vergleich der beiden Brüste nach dem Einsetzen der Implantate vermeiden. Es ist möglich, dass nach einer Brustimplantatoperation kleine Brustwanddeformitäten oder eine Störung der Brustmorphologie wesentlich deutlicher hervortreten. Die voraussichtliche Korrektur dieser Anomalien sollte daher vor der Operation mit der Patientin besprochen werden.17
Riffelung/Faltenbildung – Unter Riffelung versteht man die sicht- oder tastbare kutane Manifestation der Riffelung und des Randes des Implantats, die typischerweise am deutlichsten zum Vorschein kommen, wenn sich die Patientin nach vorne beugt. Bei einer unzureichenden Weichgewebeabdeckung des Implantats treten diese nachteiligen Effekte deutlicher zutage. Risikofaktoren für eine Riffelung hängen mit der Qualität des Brustgewebes und einer geringen Kohäsion des Implantatgels zusammen. Eine adäquate Abdeckung der Implantatriffel ist unerlässlich, um Riffelungen oder sichtbare Implantatränder zu vermeiden.
Ptosis – „Wasserfall-Effekt“ ist eine anschauliche Bezeichnung für eine Ptosis, bei der sich das parenchymatöse Brustgewebe über einem fixierten oder verkapselten Implantat nach unten bewegt. Diese Erscheinung tritt häufiger auf als von Chirurgen erwartet, vor allem im Langzeitverlauf nach einer Vergrößerung. Bestimmte Brustimplantate sind für dieses Problem eher empfänglich, und das gleiche gilt für Implantate, die in hoch liegende submuskuläre Taschen eingesetzt werden, insbesondere bei Frauen mit anatomischen muskuloskelettalen Abweichungen oder einer Asymmetrie.18
Kalzifizierung/Kalkablagerungen – Kalkablagerungen können sich im Narbengewebe um das Implantat herum bilden und Schmerzen und Verhärtungen verursachen. Kalkablagerungen sind in einer Mammographie sichtbar. Da diese Ablagerungen von Kalkablagerungen unterschieden werden müssen, die auf Brustkrebs hindeuten, kann ein zusätzlicher chirurgischer Eingriff zur Entfernung und Untersuchung von Kalzifizierungen erforderlich sein. Kalkablagerungen treten auch bei Frauen auf, die sich einer Brustverkleinerung unterziehen, bei Patientinnen mit Hämatom(en) und/oder Serom(en) in der Vorgeschichte und selbst bei Frauen, die sich keiner Brustoperation unterzogen haben. Die Auftretenshäufigkeit von Kalkablagerungen nimmt mit dem Alter signifikant zu.
Reoperation (Explantation) – Eine Ruptur, inakzeptable kosmetische Ergebnisse (z. B. Dellen, Faltenbildung und andere potenziell dauerhafte kosmetische Veränderungen der Brust) sowie sonstige Komplikationen können zusätzliche Operationen an den Brüsten der Patientin erforderlich machen.
Implantate sind nicht unbegrenzt haltbar, und es besteht die Möglichkeit, dass eine Patientin im Laufe ihres Lebens ein oder mehrere Implantate – mit oder ohne Ersatz – entfernen lassen muss. Wenn Implantate ersatzlos explantiert werden, können Veränderungen an den Brüsten irreversibel sein.
Die Patientinnen sind darauf hinzuweisen, dass bei Rekonstruktionen mit einem Ersatzimplantat ein gegenüber der Erstimplantation doppelt so hohes Risiko einer schweren Kapselkontraktur besteht. Es besteht das Risiko, dass die Integrität der Implantathülle während einer Reoperation versehentlich beeinträchtigt wird, was potenziell zu Produktversagen führen kann.
Eine Bestrahlung kann zu einer vorzeitigen Entfernung aufgrund von Extrusion, Kapselkontraktur und rezidivierendem Serom/Hämatom führen.
Sicht-/Tastbarkeit – Ein Implantat kann sicht- und tastbar werden, wenn die Hülle dünn ist. Dies kann aus verschiedenen Gründen der Fall sein, u. a. bei einem zu großen Volumen, fehlender Kohäsion der Implantatfüllung sowie aufgrund von Hautalterung. Wenn das Implantat in eine subglanduläre Tasche eingesetzt ist, muss ein Wechsel zu einer submuskulären Tasche erfolgen. Das Implantatvolumen sollte reduziert werden, und es ist sicherzustellen, dass es sich bei der Füllung um ein kohäsives Gel handelt.
Lymphadenopathie – Die silikoninduzierte Lymphadenopathie ist eine bekannte, seltene Komplikation einer Implantateinsetzung. Es handelt sich um eine Erkrankung der Lymphknoten (kleiner, runder Strukturen, die als Teil des körpereigenen Immunsystems fungieren), bei der diese eine abnormale Größe oder Konsistenz entwickeln (meist sind sie geschwollen oder vergrößert).19
Die Ursachen einer axillären Lymphadenopathie nach dem Einsetzen von Implantaten sind multifaktoriell. Zu den möglichen Faktoren zählen u. a. granulomatöse Reaktionen, Entzündungen und/oder Malignität. In der Literatur wird von Lymphadenopathie im Zusammenhang sowohl mit intakten als auch rupturierten Brustimplantaten aus Silikon berichtet, da mikroskopisch kleine Silikontröpfchen selbst bei intakter Implantatoberfläche in das Körpergewebe wandern können. Die Ruptur eines Brustimplantats und/oder ein Auslaufen durch eine intakte Fläche kann Fibrose und granulomatöse Reaktionen zur Folge haben, die wiederum eine Kontraktur oder eine regionale Lymphadenopathie nach sich ziehen und mitunter eine Malignität vortäuschen können. Es können verschiedene Muster von Lymphadeno-pathien und sogar extranodale Pathologien beobachtet werden.
Um die Ursache einer Lymphadenopathie zu ermitteln, ist eine Gewebeuntersuchung unerlässlich. Im Zweifelsfall kann die Diagnose einer silikoninduzierten Lymphadenopathie durch eine spektro- metrische Analyse bestätigt werden.
Veränderungen im Bereich der Brustwarze und im Brustgefühl – Ein brustchirurgischer Eingriff kann zu einer erhöhten/verminderten Brust- und/oder Brustwarzenempfindlichkeit führen. Typischer- weise geht die Sensitivität nach einer vollständigen Mastektomie, bei der die Brustwarze selbst entfernt wird, verloren und kann nach einer partiellen Mastektomie stark vermindert sein. Die Bandbreite der Veränderungen variiert von starker Sensitivität bis hin zu überhaupt keinem Gefühl in der Brustwarze oder Brust im Anschluss an die Operation. Einige dieser Veränderungen können vorübergehend sein, sie können aber auch dauerhaft sein und das Sexualleben der Patientin oder ihre Stillfähigkeit beeinträchtigen.20
Einige Patientinnen nehmen Tage oder Wochen nach der Brustimplantation eine erhöhte Empfindlichkeit im Bereich der Brustwarzen wahr. Das ist normal und liegt an der Dehnung des nervennahen Bereichs während der Operation. Glücklicherweise geht diese erhöhte Empfindlichkeit mit der weiteren Heilung des Gewebes wieder zurück. Das Risiko einer erhöhten Sensitivität ist gering und diese ist in der Regel nicht von Dauer.
Nekrose – Eine Nekrose ist die Bildung von abgestorbenem Gewebe im das Implantat umgebenden Bereich. Dies kann die Wundheilung verhindern und eine chirurgische Korrektur und/oder Implantatentfernung erforderlich machen. Nach einer Nekrose kann es zu bleibenden Narbendeformitäten kommen. Zu den Faktoren, die eine Nekrose begünstigen, gehören Infektionen, die Behandlung mit Kortikosteroiden in der Operationstasche, Rauchen, Chemotherapie/Bestrahlung und übermäßige Hitze- oder Kältetherapie.
Beeinträchtigung der Mammographie – Die Wichtigkeit der Mammographie sollte unterstrichen werden. Die Patientinnen sind anzuhalten, die Untersucher über das Vorhandensein, die Art und die Position ihrer Implantate zu informieren und um eine diagnostische Mammographie anstatt einer Screening-Mammographie zu bitten.21 Brustimplantate können die Interpretation von Mammographie- Aufnahmen erschweren, da sie das darunter liegende Brustgewebe verdecken und/oder das darüber liegende Gewebe zusammendrücken.
Obwohl das Vorhandensein von Brustimplantaten den Gewebekompressionsbereich bei der Mammographie verringert, haben mehrere Studien über Brustkrebs bei Frauen mit Implantaten keinen signifikanten Unterschied im Krankheitsstadium zum Zeitpunkt der Diagnose festgestellt, und die Prognose scheint bei Patientinnen mit und ohne Implantaten ähnlich zu sein.22 Um das Brustgewebe in der implantierten Brust adäquat darzustellen, sollte von akkreditierten Mammographiezentren und technischem Assistenzpersonal mit Erfahrung in der Bildgebung bei Patientinnen mit Brustimplantaten und Verschiebungstechniken Gebrauch gemacht werden. Das vordere Brustgewebe lässt sich am besten in der Verschiebungsansicht und das hintere Brustgewebe in der Kompressionsansicht darstellen. Der Rückgang des sichtbaren Bereichs um 35 % bei der Kompressionsansicht wird bei der Verschiebungsansicht auf 25 % verbessert.
Beeinträchtigung der Magnetresonanz-Bildgebung (MRT) – Motiva Implants® Brustimplantate mit Mikrotransponder gelten als bedingt MRT-tauglich. Während der MRT-Untersuchung kann der Mikrotransponder unmittelbar um sich herum einen MRT-Artefakt erzeugen (sog. Artefakt). Dies kann den Radiologen daran hindern, Teile der Ausleuchtzone des Implantats und des Gewebes der Patientin zu sehen.
Daher bestehen potenzielle zusätzliche MRT-Risiken in Verbindung mit diesem Artefakt, u. a. eine unzureichende Beurteilung der Implantathülle zur Erkennung einer Ruptur oder eine versäumte Krebsdiagnose, falls der Krebs durch den Artefaktbereich verdeckt wird.
Das berechnete Risiko, dass eine Hüllenruptur artefaktbedingt übersehen wird, liegt bei 1:166.000 Einheiten Motiva Implants® Brustimplantaten mit einem Mikrotransponder.
Das berechnete Risiko einer artefaktbedingt versäumten Brustkrebsdiagnose liegt bei einer (1) Hochrisikopatientin mit Krebsrezidiv pro 596 Hochrisikopatientinnen mit Motiva Implants® Brustimplantaten mit einem Mikrotransponder, die einer MRT-Untersuchung unterzogen werden. Wenn die MRT in Kombination mit Ultraschall (US) zur Untersuchung der Hochrisikopatientinnengruppe eingesetzt wird, wären 17.892 kombinierte MRT- plus US-Untersuchungen erforderlich, bevor eine Patientin mit Krebsrezidiv wahrscheinlich übersehen wird (falsch negatives Ergebnis).
Diese Risiken können reduziert werden, indem zusätzlich zur MRT eine US-Untersuchung durchgeführt wird, die es dem Radiologen ermöglicht, den Bereich des bei der MRT erzeugten Artefakts zu sehen. Daher sollte der Radiologe über das Vorhandensein des Mikrotransponders und dessen Lage in der Nähe des Patchbereichs im Brustimplantat informiert werden. Das Vorhandensein eines MRT- Bildgebungsartefakts und dessen erwartungsgemäße Größe müssen antizipiert werden.
SONSTIGE BERICHTETE GEGEBENHEITEN
In der Literatur wurde über weitere Gegebenheiten bei Frauen mit silikongelgefüllten Brustimplantaten berichtet. Viele dieser Gegebenheiten wurden untersucht, um ihren potenziellen Zusammenhang mit Brustimplantaten zu beurteilen. Es wurde kein kausaler Zusammenhang zwischen Brustimplantaten und den unten genannten Gegebenheiten festgestellt. Darüber hinaus ist es möglich, dass weitere, noch unbekannte Risiken auftreten, die in Zukunft mit Brustimplantaten in Verbindung gebracht werden könnten.
Neurologische Anzeichen und Symptome – Bei einigen Frauen mit Brustimplantaten sind neurologische Störungen (z. B. Sehstörungen oder Veränderungen im Bereich der Empfindung, Muskelkraft, des Gehens, Gleichgewichts, Denkens oder Gedächtnisses) oder Erkrankungen (z. B. Multiple Sklerose) aufgetreten, von denen die Betroffenen glauben, dass sie mit ihren Implantaten in Zusammenhang stehen. In der veröffentlichten Literatur gibt es jedoch keine Hinweise auf einen tatsächlichen kausalen Zusammenhang zwischen Brustimplantaten und neurologischen Erkrankungen.
Krebserkrankungen – Berichte zu Brustkrebs in der medizinischen Literatur zeigen, dass das Auftretensrisiko von Brustkrebs bei Patientinnen mit Brustimplantaten nicht höher ist als bei Frauen ohne Brustimplantate. Aus Berichten in der medizinischen Fachliteratur geht hervor, dass Brustimplantate die Feststellung von Brustkrebs nicht signifikant verzögern bzw. die Überlebensprognose der implantierten Frauen nicht nachteilig beeinflussen. Manche Studien legen sogar eine niedrigere Brustkrebsrate bei Frauen mit Brustimplantaten nahe.
Masse/Zyste in der Brust – Eine Brustzyste ist eine mit Flüssigkeit gefüllte Blase, die sich im Brustgewebe entwickelt. Diese Blasen bilden sich, wenn sich normale, Flüssigkeit produzierende Drüsen in der Brust vergrößern oder der abführende Gang blockiert ist.23 Je nach Art des Brustimplantats und der Implantatplatzierung tritt eine solche Masse manchmal bei Frauen mit dünnem Brustgewebe auf. Brustzysten werden in der Regel bei einer Selbstuntersuchung der Brust festgestellt. Wenn sie klein sind, bleiben sie oft unbemerkt oder können stattdessen in einer Mammographie zu sehen sein.
Brustatrophie – Eine Brustatrophie kann durch Alterungsprozess oder durch Druck entstehen, der gewöhnlich durch ein im Verhältnis zur Größe der Brust und der Brustwand der Patientin großes Brustimplantat ausgeübt wird.
Brustwanddeformität – Durch den Druck des Brustimplantats kann das Brustgewebe dünner werden und schrumpfen (sodass das Implantat sicht- und tastbarer wird), mit der potenziellen Folge einer Brustwanddeformität. Diese Problematik kann sowohl bei noch eingesetzten Implantaten als auch nach einer ersatzlosen Implantatentfernung auftreten.
Brustimplantat-Krankheit (Breast Implant Illness, BII) – In den letzten Jahren hat die FDA neue Informationen über systemische Symptome erhalten, die gemeinhin als Brustimplantat-Krankheit (BII) bezeichnet und von manchen Patientinnen auf ihre Implantate zurückgeführt werden. Bei manchen BII-Betroffenen wird auch eine spezifische Autoimmun- oder Bindegewebserkrankung diagnostiziert24, bei vielen aber nicht.
Die Forschung geht den Symptomen nach, um ihre Ursachen besser zu verstehen. Diese Symptome und ihre Ursachen sind nur unzureichend erforscht. Teilweise wird von einer Reversion der BII-Symptome durch das ersatzlose Entfernen der Brustimplantate berichtet.
Die Symptome können Folgendes umfassen: Störungen des zentralen Nervensystems (ZNS) (z. B. Bewusstseinstrübung, Gedächtnisverlust, Tinnitus, Schwindel, Kopfschmerzen, verschwommenes Sehen und Migräne); muskuloskelettale Erkrankungen (z. B. Fibromyalgie, Muskelschmerzen, Verfärbung der Hände, Taubheitsgefühl, Kopfschmerzen und Migräne); psychische Störungen (z. B. Angstzustände, Panikattacken und das Gefühl des bevorstehenden Todes); Immun-/ Entzündungsstörungen (z. B. Raynaud-Syndrom, Sklerodermie, Hashimoto-Thyreoiditis, Sjögren- Syndrom, Autoimmunerkrankungen, wiederkehrende Infektionen, rheumatoide Arthritis, Nachtschweiß, toxischer Schock, chronische Müdigkeit, trockene Augen, plötzliche Nahrungsmittelunverträglichkeit, systemischer Lupus erythematodes und Multiple Sklerose); Anämie sowie kardiorespiratorische und urogenitale Symptome.
Bindegewebserkrankung – Seit Anfang der 1990er Jahre wurden von den Gesundheitsministerien verschiedener Länder fast ein Dutzend umfassender systematischer Überprüfungen in Auftrag gegeben, um dem angeblichen Zusammenhang zwischen Brustimplantaten aus Silikongel und systemischen Erkrankungen nachzugehen.25 Es wurden keine stichhaltigen Beweise gefunden, die einen Zusammenhang zwischen Brustimplantaten aus Silikon und Bindegewebserkrankungen belegen würden.
In Fallberichten von Frauen mit Brustimplantaten aus Silikon und Bindegewebserkrankungen werden folgende Symptome genannt: Veränderungen des Nervensystems (z. B. Bewusstseinstrübung, Gedächtnisverlust, verschwommenes Sehen, Migräne, Tinnitus); Erkrankungen des Bewegungsapparats (z. B. muskuloskelettale Schmerzen, Fibromyalgie, Taubheitsgefühl/Kribbeln in den oberen und unteren Gliedmaßen und langsame Erholung der Muskeln nach Aktivität); immunologische/entzündliche Erkrankungen (z. B., Raynaud-Syndrom, Sjögren-Syndrom, Hashimoto-Thyreoiditis, Sklerodermie, rezidivierende/anhaltende Infektionen und rheumatoide Arthritis); gastrointestinale/genitourinale Symptome (z. B. verminderte Libido, Pankreatitis, Harnwegsinfektionen, metallischer Geschmack, Ersticken, plötzliche Erkrankung, Sodbrennen, Gastritis und Gewichtsverlust/-zunahme) sowie kardiorespiratorische und psychologische Symptome.
Neuere Studien legen nahe, dass ein solcher Zusammenhang möglich ist, da das Silikon in Brustimplantaten als Fremdkörper fungieren und eine Entzündungsreaktion auslösen kann. Mikroskopisch kleine Silikonpartikel wurden weit entfernt von der ursprünglichen Operationsstelle gefunden (z. B. in der Leber), was darauf hindeutet, dass sich eine kleine Anzahl von Silikonpartikeln aus den Implantaten löst und über das Lymph- oder Kreislaufsystem in andere Organe gelangt. Theoretisch könnten sie als Adjuvans wirken und einen Entzündungsprozess in den Gelenken auslösen oder das Immunsystem aktivieren und die Produktion von Autoantikörpern anregen. Dennoch liegen diesbezüglich keine schlüssigen Daten vor.26
Brustimplantat-assoziiertes anaplastisches großzelliges Lymphom (BIA-ALCL)27, 28 – BIA-ALCL ist eine seltene Art des T-Zell-Lymphoms, an der Zellen des Immunsystems beteiligt sind. 2016 erkannte die Weltgesundheitsorganisation (WHO) BIA-ALCL als eine Brustimplantat-assoziierte Krankheit an. Die genauen Fallzahlen lassen sich aufgrund signifikanter Einschränkungen in der weltweiten Meldung und mangelnder Daten zu den weltweiten Implantatverkäufen nur schwer ermitteln. Die meisten Daten legen nahe, dass ein BIA-ALCL nach Implantation von Brustimplantaten mit texturierten Oberflächen häufiger auftritt als nach der Implantation von Brustimplantaten mit glatten Oberflächen.
Die französische nationale Agentur für die Sicherheit von Arzneimitteln und Gesundheitsprodukten (ANSM) hat Hersteller texturierter Brustimplantate zur Durchführung von Biokompatibilitätstests aufgefordert. Establishment Labs ist dem nachgekommen. Es gibt umfangreiche medizinische Literatur zu Brustimplantaten und dem Risiko der Entwicklung eines ALCL. Nach Angaben der FDA deuten alle Informationen, die bis zum Zeitpunkt der FDA-Mitteilung vom März 2017 geprüft wurden, darauf hin, dass „Frauen mit Brustimplantaten im Vergleich zu Frauen ohne Brustimplantate ein zwar sehr geringes, jedoch erhöhtes Risiko für die Entwicklung von ALCL haben.“ Die meisten Fälle von BIA-ALCL werden durch Entfernen des Implantats und seiner umgebenden Kapsel behandelt. Einige Fälle wurden durch Chemotherapie und Bestrahlung behandelt.
In Bezug auf das BIA-ALCL richtet die FDA folgende Überlegung an die Prüfärzte: Patientinnen mit Brustimplantaten sollten von Ihnen routinemäßig weiterhin versorgt und betreut werden. BIA-ALCL ist eine sehr seltene Erkrankung, die am häufigsten bei Patientinnen festgestellt wurde, die sich aufgrund eines spät auftretenden, persistierenden Seroms einer Implantatrevision unterziehen mussten. Da sie im Allgemeinen nur bei Patientinnen mit spät auftretenden Symptomen wie Schmerzen, Knoten, Schwellungen oder Asymmetrie festgestellt wurde, wird eine prophylaktische Entfernung des Brustimplantats bei Patientinnen ohne Symptome oder sonstige Anomalien nicht empfohlen.
Aktuelle Empfehlungen umfassen die folgenden Schritte:
- Seien Sie sich bewusst, dass die meisten bestätigten Fälle von BIA-ALCL bei Frauen mit
texturierten Brustimplantaten aufgetreten sind.
- Stellen Sie Ihren Patientinnen vor der Operation die Herstellerinformationen und andere Aufklärungsmaterialien bereit und besprechen Sie mit ihnen die Nutzen und Risiken der verschiedenen Implantatarten.
Ziehen Sie die Möglichkeit eines BIA-ALCL in Betracht, wenn Sie eine Patientin mit einem spät einsetzenden, persistierenden periimplantären Serom vor sich haben. In einigen Fällen stellten sich die Patientinnen mit einer Kapselkontraktur oder einer Masse neben dem Brustimplantat vor. Wenn Sie eine Patientin mit Verdacht auf BIA-ALCL haben, überweisen Sie sie zur Untersuchung an einen geeigneten Spezialisten. Bei der Untersuchung auf BIA-ALCL sind frische Seromflüssigkeit und repräsentative Anteile der Kapsel zu entnehmen und zur pathologischen Untersuchung einzusenden, um ein BIA-ALCL auszuschließen. Die Diagnostik muss eine zytologische Untersuchung der Seromflüssigkeit mit nach Wright-Giemsa gefärbten Präparaten und eine immunhistochemische Untersuchung des Zellblocks auf Oberflächenmerkmale (Cluster of Differentiation, CD) und Marker für anaplastische Lymphomkinase (ALK) umfassen. In Abstimmung mit dem multidisziplinären Behandlungsteam der Patientin ist ein personalisierter Behandlungsplan zu erstellen. Bei der Wahl des Behandlungsansatzes sind die aktuellen Leitlinien für die klinische Praxis zu berücksichtigen, z. B. die Leitlinien der Plastic Surgery Foundation (PSF) oder des National Comprehensive Cancer Network (NCCN).
Die jüngsten statistischen Daten über gemeldete Fälle sind zu finden unter fda.gov/medical-devices/ breast-implants/questions-and-answers-about-breast-implant-associated-anaplastic-large-cell- lymphoma-bia-alcl.
Geschätzte BIA-ALCL-Inzidenz nach Produktoberfläche
Im Januar 2020 veröffentlichte die FDA einen Medizinproduktebericht zum Brustimplantat-assoziierten anaplastischen großzelligen Lymphom (BIA-ALCL). Er umfasste 733 US-amerikanische und weltweite Meldungen zu BIA-ALCL, von denen 496 (68 %) mit texturierten Brustimplantaten und 28 (4 %) mit glatten Implantaten in Zusammenhang standen. Diese Daten ähneln sehr stark den im Vorjahr berichteten Daten, die insgesamt 573 BIA-ALCL-Meldungen umfassten, von denen sich 385 (67 %) auf texturierte Brustimplantate und 26 (5 %) auf glatte Implantate bezogen, wobei es in einem Fall eine Vorgeschichte eines glatten Implantats gab und kein texturiertes Implantat bekannt war.29
Obwohl die Lebenszeitprävalenz von BIA-ALCL ursprünglich auf eine von 30.000 Frauen mit texturiertem Implantat geschätzt wurde, zeigen neuere monozentrische Studien Inzidenzraten im Bereich zwischen 1:355 und 1:559.30–32 Laut Loch-Wilkinson et al. besteht bei Implantaten mit Makrotextur ein signifikant höheres Risiko für die Entwicklung von BIA-ALCL. Laut ihrer Beschreibung hat sich gezeigt, dass texturierte Implantate mit ihrer größeren Oberfläche das Wachstum des bakteriellen Biofilms stärker begünstigen und dass diese höhere bakterielle Belastung einen signifikanten und linearen Anstieg der Lymphozytenaktivierung bewirkt33, wodurch sich das Risiko, eine BIA-ALCL zu entwickeln, im Vergleich zu mikrotexturierten Implantaten um das 14,11-Fache erhöht.34
Für Motiva Implants® wurden keine Fälle oder Inzidenzen von BIA-ALCL gemeldet; die Informationen beruhen auf Angaben in der Literatur.
GEBRAUCHSANWEISUNG
Zur einmaligen Verwendung
Dieses Produkt ist zur Verwendung bei einer einzigen Patientin im Rahmen eines einzigen Verfahrens bestimmt. Explantierte Implantate dürfen NICHT wiederverwendet werden. Bei Wiederverwendung eines Einmalprodukts könnten Patientinnen und Personal Risiken ausgesetzt werden, die den wahrgenommenen Nutzen der Verwendung derartiger Produkte überwiegen. Dieses Produkt ist nicht dazu vorgesehen, in irgendeiner Weise wiederaufbereitet und/oder erneut verwendet zu werden, auch nicht bei derselben Patientin. Bei der Wiederverwendung von Einmalprodukten können deren Sicherheit, Leistung und Wirksamkeit beeinträchtigt sein. Die Patientinnen können dadurch unnötigen Risiken ausgesetzt werden, wie z. B. Infektionen und andere Begleiterscheinungen, Serombildung, Kapselkontraktur und potenziell erforderliche Reoperation. Darüber hinaus ist es nicht möglich, die ordnungsgemäße Reinigung und Dekontamination sicherzustellen, zu gewährleisten, dass keine Reinigungsmittelrückstände vorhanden sind sowie eine Reaktion auf Endotoxine, eine Exposition gegenüber sonstigen Biogefahren und/oder das Auftreten eines Produktversagens mit Sicherheit auszuschließen. Eine solche Vorgehensweise kann auch rechtliche Folgen haben, die je nach Rechtsraum unterschiedlich sind.
Rückverfolgbarkeit des Produkts
Aufkleber für die Produktrückverfolgung liegen jedem Implantat innen in der Verpackung bei. Sie liefern produktspezifische Informationen und sollten zur Identifizierung in die Patientenakte geklebt werden. Aufkleber sind auch für den Implantatausweis der Patientin und ggf. für die Krankenhausakten verfügbar.
Der Chirurg sollte darauf hinwirken, dass die Patientin am Programm zur Produktrückverfolgung von Establishment Labs teilnimmt. Dies erfolgt durch Eingabe der Daten zu dem/den Implantat(en) unter motiva.health/motivaImagine/. Die Rückverfolgbarkeit gewährleistet, dass Establishment Labs über die Kontaktdaten der einzelnen Patientinnen verfügt, damit diese kontaktiert werden können, sollte es zu einer Maßnahme im Markt oder anderen Problemen mit den Implantaten kommen, von denen sie wissen sollten.
Steriles Produkt
Das Produkt ist herstellerseitig durch Sterilisation mittels trockener Hitze sterilisiert. Jedes sterile Silikon- Brustimplantat wird in einer versiegelten Primärverpackung mit doppelter Sterilbarriere geliefert. Zur Wahrung der Sterilität beim Verbringen des Brustimplantats in das Sterilfeld ist gemäß Standardvorgehensweisen zu verfahren. Zum Entnehmen des Brustimplantats aus der Verpackung in einer aseptischen Umgebung puderfreie Handschuhe tragen.
Die Sterilität des Implantats bleibt nur dann gewahrt, wenn die Thermoform-Verpackungen, einschließlich der Verpackungsversiegelung, intakt sind.
Das Produkt NICHT verwenden, wenn die Thermoform-Verpackungen oder Versiegelungen vor der Verwendung beschädigt oder versehentlich geöffnet wurden.
Das Produkt NICHT erneut sterilisieren.
Eine längere Exposition gegenüber extremen Lagerungsbedingungen ist zu vermeiden. Es wird empfohlen, diese Produkte bei Raumtemperatur, im Atmosphärendruckbereich und vor Feuchtigkeit und direkter Sonneneinstrahlung geschützt zu lagern.
KEIN Produkt implantieren, das augenscheinlich durch Partikel verunreinigt ist, beschädigt ist oder dessen Hülle nicht mehr unversehrt ist. Zum Zeitpunkt der Operation muss ein steriles Reserveimplantat bereitliegen.
KEIN Produkt implantieren, das augenscheinlich Anzeichen einer Leckage oder Kratzer aufweist.
Öffnen einer sterilen Produktverpackung
Das Brustimplantat NICHT mit Puder, Schwämmen, Handtüchern oder sonstigen Verunreinigungen in Berührung bringen.
- Die Umverpackung muss von einem nicht sterilen Teammitglied geöffnet werden.
- Die innere Verpackung herausnehmen und über dem sterilen Feld umstülpen, sodass die versiegelte innere Thermoform-Verpackung in das Sterilfeld gleiten kann.
- Mit der Zuglasche den Deckel von der inneren Thermoform-Verpackung abziehen.
- Das Brustimplantat entnehmen und auf Verunreinigungen durch Partikel, Beschädigungen bzw. Unversehrtheit der Hülle untersuchen. Wenn das Ergebnis zufriedenstellend ist, das Brustimplantat wieder in die innere Thermoformschale legen. Jetzt kann das Implantat auf Wunsch leicht mit einer kleinen Menge Kochsalzlösung abgespült werden, um die statische Ladung zu beseitigen. Bis zur Implantation wird die Schale mit dem Deckel abgedeckt, um Kontakt mit Verunreinigungen in der Luft und Verunreinigungspartikeln im OP-Feld zu vermeiden.
Verläuft dies nicht zufriedenstellend, muss das Produkt durch ein steriles Reserveimplantat ersetzt werden.
Hinweis: Zum Zeitpunkt der Operation muss ein steriles Reserveimplantat bereitliegen.
Operationstechnik und Implantatauswahl
Brustimplantate können über verschiedene Inzisionen und in mehreren Gewebeebenen, den soge- nannten Taschenebenen, positioniert werden. Die Auswahl dieser Tasche ist häufig ein für das Erreichen des gewünschten Ergebnisses bei der jeweiligen Patientin entscheidender Prozess. Dabei ist es unerlässlich, eine Tasche zu wählen, die den spezifischen Bedingungen der physischen/historischen Merkmale der Patientin entspricht und gleichzeitig ein geringes Komplikationsrisiko birgt. Chirurgen sollten bei der Auswahl von Implantaten die publizierten Grundsätze berücksichtigen, mit denen die Risiken kurz- und langfristiger Komplikationen minimiert werden.
Wahl der Implantatplatzierung
Submuskuläre/subpektorale Platzierung – Zu den Vorteilen dieser Technik zählen unter anderem eine bessere Weichgewebeabdeckung, ein geringeres Risiko einer Sicht- und Tastbarkeit des Implantats, einer Kapselkontraktur und Infektion sowie eine geringere Beeinträchtigung bei der Mammographie.
Es wurde über mögliche Komplikationen in Bezug auf die Platzierung von Implantaten in der submuskulären Tasche berichtet, u. a. eine komplexe Operationstechnik, eine verlängerte postoperative Erholungszeit, Morbidität und stärkere Schmerzen, aber auch eine schlechtere Kontrolle der Brustform, Verlust der Position und der Brustumschlagsfalte mit der Folge eines unnatürlichen Erscheinungsbildes mit beträchtlicher Asymmetrie sowie ein größeres Risiko einer Fehlpositionierung durch „Hochrutschen“ (superior/lateral), einer sog. „Double-Bubble“-Deformität und einer Einschnürung des unteren Pols.
Zu den Indikationen für subglanduläre oder subfasziale Taschenpositionen gehören Operationen zur Implantation eines primären Brustimplantats und Revisions-Rekonstruktionen sowie Patientinnen, die nach einem Revisionseingriff aufgrund einer bestimmten Komplikation einen Wechsel der Tasche von einer zuvor verwendeten dualen, submuskulären oder subfaszialen Ebene benötigen.
Zu den Vorteilen dieser Taschenlage gehören unter anderem eine mühelosere Operationstechnik, eine bessere Kontrolle der Form, der Position und der Brustumschlagsfalte, eine kürzere Operationsdauer, eine schnellere postoperative Genesung, weniger Schmerzen und Schwellungen sowie ein geringeres Risiko für sog. Animation-Deformitäten. Es wurde über mögliche Komplikationen im Zusammenhang mit dieser Operationstechnik berichtet, u. a. eine erhöhte Sicht- und Tastbarkeit des Implantats, ein Verrutschen nach unten (sog. „Bottoming-out“-Fehllage), Infektionen und Kapselkontrakturen.
Subfaszial – Dies ist ein Ansatz für eine alternative Implantattasche. Bei der subfaszialen Präparation bleiben die Muskelfasern erhalten und das Implantat kann besser positioniert werden. Außerdem begünstigt die Brustmuskelfaszie das Anlegen einer Stützstruktur für den oberen Pol des Implantats und vermeidet die Dislokation des Implantats nach oben, wodurch der obere Pol natürlicher wirkt. Die positiven Aspekte liegen in einer im Vergleich zur submuskulären Position schmerzfreien Genesung und in der Bereitstellung einer zusätzlichen Gewebeabdeckung für das Implantat.
Zwei Ebenen – Bei dieser Technik werden unterschiedliche Grade der Weichgewebeabdeckung zwischen der subpektoralen und der subglandulären Platzierung kombiniert. Dies ermöglicht es dem Chirurgen, die individuellen Bedürfnisse hinsichtlich der Gewebeabdeckung zu berücksichtigen. Die Platzierung in zwei Ebenen ist in drei Arten unterteilt: Platzierung in zwei Ebenen I, II und III.
Zu den Indikationen für die Platzierung in zwei Ebenen zählen: Implantation eines primären Implantats und primäre Rekonstruktionsoperationen (ein-/zweistufig).
Zu den berichteten Vorteilen dieser Techniken zählen u. a.: bessere Weichgewebeabdeckung, geringere Beeinträchtigung der Mammographie, bessere Fülle des unteren Pols und bessere Kontur des oberen und mittleren Pols. Zu den berichteten Risiken dieser Technik zählen u. a.: Sichtbarkeit des Implantats, Tastbarkeit, Kapselkontraktur und gewisse Animation-Deformitäten.
Während der Operation
Es ist ratsam, zum Zeitpunkt der Operation verschiedene Brustimplantat-Größen im Operationssaal bereitzuhalten, um bei der Bestimmung der geeigneten Größe flexibel zu sein.
- Auch sollte ein Reserveimplantat zur Hand sein.
- Bitte beachten, dass beim Einsetzen des Produkts keine übermäßige Kraft auf einen kleinen Bereich der Hülle ausgeübt werden darf. Stattdessen sollte die Kraft über einen möglichst großen Bereich des Implantats angewendet werden.
- Die Inzision sollte ausreichend lang sein, um das Volumen und Profil des mit einem hochkohäsiven Gel gefüllten Implantats aufzunehmen und so die Gefahr einer übermäßigen Implantatbelastung beim Einsetzen zu verringern. Das Forcieren von Implantaten durch eine sehr kleine Öffnung kann das Gel des Implantats beschädigen und möglicherweise eine Ruptur des Implantats oder einen Gelriss verursachen. Bei einem Gelriss während der Implantation darf das Implantat nicht in den Körper der Patientin eingesetzt werden, sondern muss durch ein neues Implantat ersetzt werden.
- Eine unzureichende Taschenpräparation erhöht das Risiko einer Ruptur und einer Fehlpositionierung des Implantats. Es muss eine gut definierte, trockene Tasche von angemessener Größe und Symmetrie geschaffen werden, sodass das Implantat flach auf eine glatte Oberfläche platziert werden kann.
- Alle Produkte müssen vor dem Einsetzen in den Körper der Patientin im Rahmen der Brustimplantation gründlich auf Gelriss, Luftblasen im Gel oder sonstige Produktmängel untersucht werden. Kein Implantat einsetzen, das an irgendeiner Stelle Gelrisse aufweist, stattdessen ein neues Implantat verwenden.
- Bei der Explantation muss der Chirurg die Unversehrtheit des Brustimplantats intraoperativ beurteilen, um festzustellen, ob eine Ruptur, ein Gelriss oder eine Gelmigration vorliegt. Bei einem Produktversagen muss das Implantat zur Überprüfung an Establishment Labs geschickt werden.
- KEINE Gleitmittel während der Platzierung verwenden, da diese das Risiko einer Taschenkontamination erhöhen und die Gewebe-Kapsel-Schnittstelle beeinträchtigen können.
- NICHT das Brustimplantat mit spitzen bzw. scharfkantigen chirurgischen Instrumenten (z. B. Nadeln und Skalpelle), stumpfen Instrumenten (z. B. Klemmen und Pinzetten) oder durch übermäßige Handhabung und Manipulation beim Einführen in die chirurgische Tasche beschädigen.
- KEINE übermäßige Kraft während der Platzierung des Implantats anwenden.
- NICHT das Implantat manipulieren, um eine radiale Expansion, Kompression oder Präparation der Tasche zu erreichen.
- NICHT mehr als ein Implantat pro Brusttasche verwenden.
Aufrechterhaltung der Hämostase/Vermeidung von Flüssigkeitsansammlungen
Das Risiko eines postoperativen Hämatoms und Seroms kann durch sorgfältige Blutstillung während der Operation und möglicherweise durch die postoperative Verwendung eines geschlossenen Drainagesystems reduziert werden. Anhaltende oder starke Blutungen müssen vor der Implantation unter Kontrolle gebracht werden. Jede postoperative Evakuierung eines Hämatoms oder Seroms muss vorsichtig erfolgen, um eine Kontamination oder Beschädigung des Brustimplantats zu vermeiden.
SPEZIFISCHE GEBRAUCHSANWEISUNG FÜR BRUSTIMPLANTATE MIT MIKROTRANSPONDER
Beschreibung und Verwendung
Motiva Implants® Brustimplantate mit Mikrotransponder enthalten ein dauerhaft implantierbares Hochfrequenz-Identifikationsgerät (RFID), das sicher in das Füllmaterial des Brustimplantats eingebettet ist. Scanner zum Auslesen der Informationen auf dem Mikrotransponder sind separat erhältlich. Der Mikrotransponder ist ein passives RFID, das mithilfe von Funkwellen eine elektronische Seriennummer (ESN) bereitstellt, welche die vollständige Nachverfolgbarkeit der implantatspezifischen Daten gewährleistet.
Der Mikrotransponder im Brustimplantat stellt der Patientin eine ESN bereit, mit der auf eine Datenbank mit Informationen zum Brustimplantat (d. h. Serien- und Chargennummern, Referenznummer, Volumen, Größe und Projektion, Modell, Oberflächenart, Herstellungsdatum usw.) zugegriffen werden kann.
Vorsichtshinweise
Patientinnen mit Brustimplantaten, die einen Mikrotransponder enthalten, können sich gefahrlos einer MRT-Diagnostik in zylindrischen Systemen mit bis zu drei Tesla unterziehen. Ausführliche Anweisungen hierzu enthält der folgende Abschnitt „Hinweise für Patientinnen, die sich einer MRT unterziehen“.
Hinweise für Patientinnen, die sich einer MRT unterziehen
Den Patientinnen ist anzuraten, im Laufe ihres Lebens regelmäßige MRT-Untersuchungen durchführen zu lassen, um eine stille Ruptur auszuschließen, auch wenn keine augenscheinlichen Probleme bestehen. Wie bereits erwähnt, empfiehlt die FDA die erste MRT-Untersuchung drei Jahre nach der Operation und anschließend in regelmäßigen Abständen von zwei Jahren.
Die Patientin muss während des gesamten MRT-Verfahrens visuell und akustisch (z. B. über eine Sprechanlage) überwacht werden. Die Patientin ist anzuweisen, den Bediener des MRT-Systems auf ungewöhnliche Empfindungen oder Probleme aufmerksam zu machen, damit das Verfahren erforderlichenfalls sofort abgebrochen werden kann. Geben Sie der Patientin die Möglichkeit, das MRT- Bedienungspersonal auf ungewöhnliche Empfindungen oder Probleme aufmerksam zu machen.
Eine MRT darf nicht durchgeführt werden, wenn die Patientin sediert, betäubt oder verwirrt ist oder aus anderen Gründen nicht mit dem Bediener des MRT-Systems kommunizieren kann.
Motiva Implants® Brustimplantate sind als bedingt MRT-sicher gekennzeichnet. Eine Patientin, bei der Motiva Implants® Ergonomix2® sterile Brustimplantate aus Silikon implantiert sind, kann unter folgenden Bedingungen einem MRT-Scan unterzogen werden:
- Statisches Magnetfeld von nur 1,5 Tesla und 3 Tesla
- Maximaler räumlicher Magnetfeldgradient von 4.000 Gauss/cm (40 T/m) (extrapoliert)
- Maximale für MR-Systeme angegebene ganzkörpergemittelte spezifische Absorptionsrate (SAR) von 2 W/kg pro 15-minütigem Scannen (d. h. pro Impulssequenz) im normalen Betriebsmodus
- Unter den definierten Scan-Bedingungen wird erwartet, dass die Motiva Implants® Ergonomix2® sterilen Brustimplantate aus Silikon mit Mikrotransponder nach einem unterbrechungsfreien Scan von 15 Minuten Dauer (d. h. pro Pulssequenz) einen maximalen Temperaturanstieg von 1,5 °C bewirken.
Die magnetisch induzierte Verschiebung und die magnetisch induzierten Drehmomente wurden geprüft. Es wurden keine klinisch bedeutsamen Verschiebungen oder Drehmomente festgestellt. Motiva Implants® Implantate mit Mikrotransponder erzeugen bei der MRT von Brustimplantaten eine Lücke in der Bildgebung (als Artefakt-Effekt bezeichnet), welche die Visualisierung eines kleinen Bereichs um den Mikrotransponder verhindern kann. In nicht klinischen Untersuchungen erstreckt sich das durch Motiva Implants® verursachte Bildartefakt bis ca. 15 mm radial des RFID, wenn die Bildgebung mit einer Gradientenecho-Impulssequenz und einem 3-Tesla-MR-System erfolgt.
In ausgewählten Fällen werden zusätzliche bildgebende Verfahren wie Ultraschall, Tomosynthese, digitale Kompressionsmammographie, Subtraktionskontrastmammographie und Szintimammographie empfohlen, um die Visualisierung der vom Artefakt betroffenen Region zu ergänzen und die Gesamtdiagnose zu verbessern.
Herstellerseitig durchgeführte Studien deuten darauf hin, dass die Verwendung einer „kombinierten“ oder „dualen“ Modalität, bei der zusätzliche bildgebende Technologien eingesetzt werden (z. B. MRT plus Ultraschall, Mammographie, Tomosynthese usw.), die diagnostische Verfahrensgenauigkeit bei den Motiva Implant® Ergonomix2® sterilen Brustimplantaten aus Silikon mit Mikrotransponder erheblich verbessern kann. Die Ergänzung um weitere bildgebende Verfahren unter Verwendung von Standardpraktiken ermöglicht eine vollständige radiologische Untersuchung der Brust.
ZUSÄTZLICHE ANWEISUNGEN FÜR DEN GEBRAUCH
Es folgen zusätzliche Anweisungen für Brustimplantate mit Mikrotransponder:
- Vor dem Öffnen der Sterilbarrieren ist der Mikrotransponder im Implantat mit dem entsprechenden Scanner zu überprüfen, sofern ein solcher verfügbar ist.
Vorsicht
Erleidet der Brustbereich später ein physisches Trauma infolge eines Unfalls oder einer Verletzung, muss die Patientin den Arzt konsultieren, um sicherzustellen, dass der Mikrotransponder ordnungsgemäß funktioniert. Sollte der Mikrotransponder aus irgendeinem Grund nicht mehr vom entsprechenden Scanner ausgelesen werden können, beeinträchtigt dies nicht die ordnungsgemäße Funktion des Brustimplantats und stellt keine Komplikation dar.
Produktrückverfolgung
Mit Silikongel gefüllte Brustimplantate unterliegen der Produktrückverfolgung. Die Einhaltung dieser Anforderung ist zwingend vorgeschrieben. Daher müssen die Chargen- und Seriennummern der Produkte, die einer Patientin implantiert wurden, das Datum der Operation, die Identifikationsnummer und die persönlichen Kontaktangaben sowie die Informationen zur Praxis des Chirurgen direkt oder über einen Vertreter an Establishment Labs gemeldet werden.
Establishment Labs empfiehlt allen Patientinnen, die mit Silikongel gefüllte Brustimplantate erhalten, nachdrücklich die Teilnahme am Produktrückverfolgungsprogramm von Establishment Labs durch Eingabe ihrer Implantatinformationen unter motiva.health/motivaImagine/. Dies gewährleistet, dass Establishment Labs über die Kontaktdaten der einzelnen Patientinnen verfügt, damit diese kontaktiert werden können, sollte es zu einer Maßnahme im Markt oder anderen Umständen im Zusammenhang mit den Implantaten kommen, von denen sie wissen sollten.
Anweisungen und Vorsichtshinweise für die Entfernung
Zu den häufigsten Gründen für die Entfernung von Brustimplantaten gehören Komplikationen wie Kapselkontraktur, Implantatruptur und -fehllage sowie der Wunsch der Patientin nach einer Änderung der Implantatgröße oder -form. Dem Chirurgen wird empfohlen, bei der Auswahl der aktuellen und anerkannten chirurgischen Techniken zur Entfernung und zum Ersatz von Brustimplantaten sein medizinisches Urteilsvermögen walten zu lassen, um das Auftreten von unerwünschten Reaktionen zu minimieren und die besten Ergebnisse für die Patientin zu erzielen.
Bedingungen für die Lagerung und Handhabung
Für den Transport der Produkte gelten keine speziellen Bedingungen. Es wird jedoch empfohlen, die verpackten Produkte in einem dafür vorgesehenen sauberen Bereich innerhalb des Krankenhauses/ der Klinik aufzubewahren und unter Raumbedingungen flach liegend zu lagern.
Verfallsdatum
Das Verfallsdatum des Produkts ist auf der Verpackungskennzeichnung angegeben.
WARNHINWEIS: Establishment Labs übernimmt keine Garantie für die Sterilität, wenn das Produkt nach dem Verfallsdatum verwendet wird.
Entsorgung
Produkte, die nicht an den Hersteller zurückgeschickt werden, sind als biogefährlich und infektiös zu handhaben. Gebrauchte Produkte können in einer geeigneten Entsorgungsbox entsorgt und anschließend durch einen spezialisierten Sammeldienst oder entsprechend den örtlichen Vorschriften verbrannt werden.
Die unsachgemäße Handhabung explantierter Produkte kann unnötige Risiken, wie bspw. Infektions- gefahr oder mikrobielle Gefährdung, zur Folge haben.
Angaben zur voraussichtlichen Lebensdauer
Motiva Implants® Implantate sind nicht unbegrenzt haltbar. Auf der Grundlage der chemischen Eigenschaften der bei den Motiva®-Produkten verwendeten Materialien, der beschleunigten Alterungstests für eine Lagerungsdauer von fünf Jahren, der im Rahmen der Überwachung nach dem Inverkehrbringen gewonnenen Informationen und der Sichtung umfangreicher klinischer Literaturdaten zu gleichwertigen Produkten wurde eine Überlebensrate von 80 % nach 10 Jahren als Akzeptanzkriterium für die Lebensdauer von Motiva Implants® Implantaten festgelegt.35
Die tatsächliche Lebensdauer des einzelnen Implantats lässt sich nicht genau vorhersagen. Es ist allgemein bekannt, dass mehrere Faktoren, die sich der Kontrolle des Herstellers entziehen, einen erheblichen Einfluss auf die Lebensdauer des einzelnen Produkts haben. Zu diesen Faktoren gehören das eigentliche Implantationsverfahren, die Anatomie und der Gesundheitszustand der Patientin, das Verhalten und die üblichen Aktivitäten der Patientin (z. B. sportliche Aktivitäten) sowie vorhersehbare und unvorhersehbare äußere mechanische Einflussfaktoren.
Vorgehensweise für die Registrierung und Implantatausweis
Jedem Brustimplantat liegen 10 Aufkleber für die Patientenakte bei, auf denen die Referenznummer, die Seriennummer und das Implantatvolumen sowie andere laut Gesetzgeber erforderliche Angaben vermerkt sind. Die Aufkleber für die Patientenakte befinden sich auf der inneren Produktverpackung und sind an der Hauptkennzeichnung befestigt. Zum Ausfüllen des Implantatausweises für die Patientin wird für jedes Implantat ein Aufkleber auf die Rückseite des Patientenausweises geklebt. Ein weiterer Aufkleber ist in die Krankenakte der Patientin einzukleben. Ein dritter Aufkleber ist für die Unterlagen des Arztes vorgesehen. Der vierte Aufkleber ist gegebenenfalls für Krankenhausakten vorgesehen; weitere Aufkleber können je nach Bedarf verwendet werden, um die Rückverfolgbarkeit des Produkts zu gewährleisten. Steht kein Aufkleber für die Patientenakte zur Verfügung, können die entsprechenden Informationen von Hand vom Produktetikett abgeschrieben werden.
Implantatausweis für Patientinnen
Jede Patientin muss eine Kopie des Operationsberichts haben, um bei künftigen Konsultationen oder weiteren Operationen darauf zurückgreifen zu können. Jedem Implantat liegt ein Implantatausweis bei, welcher der Patientin zur persönlichen Bezugnahme auszuhändigen ist. Im Implantatausweis müssen die Implantataufkleber eingeklebt werden. Der Implantatausweis enthält folgende Informationen: Produktart, Name der Patientin, Position des Implantats (d. h. submuskulär, subglandulär, zwei Ebenen oder subfaziale Ebene), Datum der Implantation, Name des behandelnden Chirurgen, Hersteller- informationen, UDI, Produktbezeichnung, Seriennummer und Implantatvolumen.
PRODUKTEVALUIERUNG
Alle sich im Zusammenhang mit der Verwendung dieses Produkts ergebenden Komplikationen müssen Establishment Labs unverzüglich anhand des Meldeformulars für Beschwerden mitgeteilt werden. Das Formular ist zu adressieren an: Establishment Labs S. A., Coyol Free Zone and Business Park Building, 4th Street, Building B-15, Alajuela, Costa Rica. Sollten Sie weitere Unterstützung benötigen, rufen Sie uns bitte unter der Rufnummer +506 2434-2400 an oder kontaktieren Sie uns über motiva.health/patients-support/.
MELDUNGEN UND PRODUKTRÜCKGABE
Im Falle einer Explantation ist der Grund für die Explantation auf dem Meldeformular für Beschwerden zu vermerken und das explantierte Produkt an die örtliche Vertretung von Establishment Labs einzusenden. Ist keine örtliche Vertretung verfügbar, wenden Sie sich bitte direkt an: Establishment Labs S.A., Coyol Free Zone and Business Park Building, 4th Street, Building B-15, Alajuela, Costa Rica. Sollten Sie weitere Unterstützung benötigen, rufen Sie uns bitte unter der Rufnummer +506 2434-2400 an oder kontaktieren Sie uns über motiva.health/patients-support/.
Gemäß dem Rückgabeprotokoll für explantierte Implantate von Establishment Labs muss das explantierte Produkt vor der Rücksendung dekontaminiert und ordnungsgemäß verpackt werden. Falls die örtlichen Gesundheitsvorschriften eine Rücksendung des Implantats nicht zulassen, wenden Sie sich bitte direkt an uns unter motiva.health/patients-support/, um spezifische Anweisungen zu erhalten.
Jedes schwerwiegende Ereignis im Zusammenhang mit Motiva® Implantaten muss Establishment Labs und der für den Wohnsitz der Patientin zuständigen Behörde gemeldet werden, soweit dies den gesetzlichen Bestimmungen vor Ort entspricht.
RICHTLINIEN FÜR DIE PRODUKTRÜCKSENDUNG
Produktrücksendungen sind über die lokale Vertretung von Establishment Labs abzuwickeln. Ist keine örtliche Vertretung verfügbar, wenden Sie sich bitte direkt an: Establishment Labs S.A., Coyol Free Zone and Business Park Building, 4th Street, Building B-15, Alajuela, Costa Rica. Sollten Sie weitere Unterstützung benötigen, rufen Sie uns bitte unter der Rufnummer +506 2434-2400 an oder gehen Sie zu motiva.health.
Alle Verpackungsversiegelungen müssen intakt sein, damit die Produkte für eine Rücksendung in Frage kommen. Für zurückgesendete Produkte kann eine Wiedereinlagerungsgebühr erhoben werden. Weitere Informationen sind von der lokalen Vertretung von Establishment Labs erhältlich.
PRODUKTBESTELLUNG
Bestellungen können direkt bei der lokalen Vertretung von Establishment Labs aufgegeben werden. Dort können auch Produktinformationen angefordert werden. Ist keine örtliche Vertretung verfügbar, wenden Sie sich bitte direkt an: Establishment Labs S.A., Coyol Free Zone and Business Park Building, 4th Street, Building B-15, Alajuela, Costa Rica. Sollten Sie weitere Unterstützung benötigen, rufen Sie uns bitte unter der Rufnummer +506 2434-2400 an oder senden Sie eine E-Mail an customerservice@establishmentlabs.com. Ausführliche Informationen zu Indikationen, Kontraindikationen, Warn- und Vorsichtshinweisen im Zusammenhang mit den Motiva Implants® Ergonomix2® sterilen Brustimplantaten aus Silikon können der jedem Produkt beiliegenden Packungsbeilage entnommen werden.
BESCHRÄNKTE ALWAYS CONFIDENT WARRANTY® VON ESTABLISHMENT LABS, HAFTUNGS- BESCHRÄNKUNG UND AUSSCHLUSS SONSTIGER GARANTIEN
Die vollständigen Bestimmungen, Bedingungen und Beschränkungen der Selbstvertrauen-Garantie (Always Confident Warranty®) von Establishment Labs können auf der Webseite motiva.health eingesehen oder von der örtlichen Vertretung von Establishment Labs bereitgestellt werden. Keine Garantie bzw. kein Programm von Establishment Labs deckt Kosten, Honorare oder Ausgaben im Zusammenhang mit einer medizinischen Behandlung und/oder dem operativen Austausch der Implantate ab. Establishment Labs übernimmt keine Haftung für zufällige oder sich in Folge ergebende Verluste, Schäden oder Kosten, die direkt oder indirekt aufgrund der Verwendung dieses Produkts entstehen. Falls Establishment Labs feststellt, dass das Produkt bei Versand durch Establishment Labs
fehlerhaft war, ist Establishment Labs ausschließlich für den Ersatz des Produkts verantwortlich. Establishment Labs S.A. übernimmt keine weitere Haftung. Diese Garantie tritt an die Stelle aller anderen Garantien, die hierin nicht ausdrücklich genannt sind, seien sie ausdrücklicher oder stillschweigender Art, ob durch Gesetz oder anderweitig begründet, insbesondere stillschweigende Garantien der Marktgängigkeit, Eignung für einen bestimmten Zweck oder eine bestimmte Leistung.
LEGALER HERSTELLER
Establishment Labs S.A.:
Coyol Free Zone & Business Park Building, 4th Street, Building B15, Alajuela, Costa Rica
Postleitzahl: 20113
Rufnummer: +506 2434-2400
www.establishmentlabs.com motiva.health/patients-support/motiva.health https://ifu.motiva.health/
HERSTELLUNGSORTE Establishment Labs S.A. Coyol Free Zone
2nd Street, Building B23 Alajuela, 20113, Costa Rica
Coyol Free Zone & Business Park Building 4th Street, Building B15
Alajuela, 20113, Costa Rica
Coyol Free Zone & Business Park Building 0 Street, Building B25
Alajuela, 20113, Costa Rica
EUROPÄISCHER BEVOLLMÄCHTIGTER
Emergo Europe: Westervoortsedijk 60, 6827 AT Arnhem, Niederlande
IMPORTEUR IN DEN EUROPÄISCHEN WIRTSCHAFTSRAUM EDC Motiva BVBA
Nijverheidsstraat 96, Wommelgem
Antwerpen 2160, Belgien
In der Produktkennzeichnung verwendete Symbole (einschließlich nicht-harmonisierter Symbole)
1 Loureno FR, Kikuchi IS, Andreoli Pinto T de J. Silicone Gel Bleed on Breast Implants. Open Biomater J. 2011;3(Oktober):14–17. doi:10.2174/1876502501103010014
2 Berman B, Maderal A, Raphael B. Keloids and Hypertrophic Scars: Pathophysiology, Classification, and Treatment. Dermatol Surg. Jan. 2017;43 Beilage 1:S3–S18. doi: 10.1097/DSS.0000000000000819. PMID: 27347634.
3 Mañero, Ivan M.D.; Montull, Patricia M.D.; Guisantes, Eva M.D. Bottoming Out: A Simple Technique for Correcting Breast Implant Displacement. Plastic and Reconstructive Surgery: Dezember 2009 – Band 124 – Ausgabe 6 – S. 452e–453e
4 Headon H, Kasem A, Mokbel K. Capsular Contracture after Breast Augmentation: An Update for Clinical Practice. Arch Plast Surg. Sep. 2015;42(5):532–43. doi: 10.5999/aps.2015.42.5.532. Epub 15. Sep. 2015 PMID: 26430623; PMCID: PMC4579163.
5 Song JH, Kim YS, Jung BK, Lee DW, Song SY, Roh TS, Lew DH. Salvage of Infected Breast Implants. Arch Plast Surg. Nov. 2017;44(6):516–522. doi: 10.5999/aps.2017.01025. Epub 27. Okt. 2017 PMID: 29076316; PMCID: PMC5801791.
6 Franchelli S, Pesce M, Baldelli I, Marchese A, Santi P, De Maria A. Analysis of clinical management of infected breast implants and of factors associated to successful breast wrinkling of the implant shell, excessive force to the chest, trauma, compression during mammographic imaging, and severe capsular contracture.
7 Sood A, Kotamarti VS, Therattil PJ, Lee ES. Sclerotherapy for the Management of Seromas: A Systematic Review. Eplasty. 28. Aug. 2017;17:e25. PMID: 28890747; PMCID: PMC5575675.
8 Gioacchini M, Bottoni M, Grassetti L, Scalise A, Di Benedetto G. A simple, reliable, and inexpensive method for seroma drainage. Arch Plast Surg. Mai 2015;42(3):361–2. doi: 10.5999/aps.2015.42.3.361. Epub 14. Mai 2015 PMID: 26015895; PMCID: PMC4439599.
9 Sforza M, Husein R, Atkinson C, Zaccheddu R. Unraveling Factors Influencing Early Seroma Formation
in Breast Augmentation Surgery. Aesthet Surg J. 1. März 2017;37(3):301–307. doi: 10.1093/asj/sjw196.
PMID: 28207027.
10 FDA. Risks and Complications of Breast Implants. Veröffentlicht 2020 https://www.fda.gov/medical-devices/breast-implants/risks-and-complications-breast-implants
11 Hillard C, Fowler JD, Barta R, Cunningham B. Silicone breast implant rupture: a review. Gland Surg.
Apr. 2017;6(2):163–168. doi: 10.21037/gs.2016.09.12. PMID: 28497020; PMCID: PMC5409893.
12 Update on the Safety of Silicone Gel-Filled Breast Implants (2011) – Executive Summary (2011). Zugriff am 26. März 2021. https://www.fda.gov/medical-devices/breast-implants/update-safety-silicone-gel-filled- breast-implants-2011-executive-summary
13 Levenson, Toby; Greenberger, Paul A; Murphy, Robert (1996). Peripheral Blood Eosinophilia, Hyperimmunoglobulinemia A and Fatigue: Possible Complications Following Rupture of Silicone Breast Implants. 77(2), 119–122. doi: 10.1016/S1081-1206(10)63497-7
14 Breast Cancer. Breast Implant Extrusion. Veröffentlicht 2020. https://www.breastcancer.org/treatment/surgery/ breast-reconstruction/corrective-reconstruction/implant-extrusion
15 Jong, Justin MD*; Gabriel, Allen MD, FACS†; Trekell, Melissa MD‡; Lawser, Amy S. MSN, RN§;
Heidel, Eric PhD; Buchanan, Dallas MD, FACS; Chun, Joseph T. MD, FACS** Cohesive Round Implants and the Risk of Implant, Plastic and Reconstructive Surgery – Global Open: Dezember 2020 – Band 8 – Ausgabe 12 –
- e3321 doi: 10.1097/GOX.0000000000003321
16 Karan Chopra, MD, Arvind U. Gowda, MD, Edwin Kwon, MD, Michelle Eagan, MD, W. Grant Stevens, MD, Techniques to Repair Implant Malposition after Breast Augmentation: A Review, Aesthetic Surgery Journal,
Band 36, Ausgabe 6, Juni 2016, Seiten 660–671, https://doi.org/10.1093/asj/sjv261
17 Breast Asymmetry (2019). Zugriff am auf 26. März 2021. https://www.breastcancer.org/treatment/surgery/ reconstruction/corrective/asymmetry
18 Frame J. The waterfall effect in breast augmentation. Gland Surg. Apr. 2017;6(2):193–202.
doi: 10.21037/gs.2016.10.01. PMID: 28497023; PMCID: PMC5409900
19 Lee Y, Song SE, Yoon ES, Bae JW, Jung SP. Extensive silicone lymphadenopathy after breast implant insertion mimicking malignant lymphadenopathy. Ann Surg Treat Res. Dez. 2017;93(6):331–335. doi: 10.4174/ astr.2017.93.6.331. Epub 1. Dez. 2017 PMID: 29250513; PMCID: PMC5729128.
20 Araco A, Araco F, Sorge R, Gravante G. Sensitivity of the nipple-areola complex and areolar pain following aesthetic breast augmentation in a retrospective series of 1200 patients: Periareolar versus submammary incision. Plast Reconstr Surg. 2011;128(4):984–989. doi: 10.1097/PRS.0b013e3182268d73
21 Sá Dos Reis C, Gremion I, Richli Meystre N. Study of breast implants mammography examinations for identification of suitable image quality criteria. Insights Imaging. 3. Jan. 2020;11(1):3.
doi: 10.1186/s13244-019-0816-5. PMID: 31900684; PMCID: PMC6942083.
22 Hölmich LR, Mellemkjaer L, Gunnarsdóttir KA, Tange UB, Krag C, Møller S, McLaughlin JK, Olsen JH. Stage of breast cancer at diagnosis among women with cosmetic breast implants. Br J Cancer. 24. März 2003;88(6):832–8. doi: 10.1038/sj.bjc.6600819. PMID: 12644818; PMCID: PMC2377078.
23 The NSW Breast Cancer Institute (2006). Breast cysts – An information guide for patients 24 FDA. Risks and Complications of Breast Implants. Veröffentlicht 2020. https://www.fda.gov/medical-devices/breast-implants/risks-and-complications-breast-implants
25 Balk EM, Earley A, Avendano EA, Raman G. Long-Term Health Outcomes in Women With Silicone Gel Breast Implants: A Systematic Review. Ann Intern Med. 2. Feb. 2016;164(3):164–75. doi: 10.7326/M15-1169. Epub
- Nov. 2015 PMID: 26550776.
26 Hölmich LR, Lipworth L, McLaughlin JK, Friis S. Breast implant rupture and connective tissue disease: A review of the literature. Plast Reconstr Surg. 2007;120(7 SUPPL. 1):62–69. doi: 10.1097/01.prs.0000286664.50274.f2
27 Clemens MW, Nava MB, Rocco N, Miranda RN. Understanding rare adverse sequelae of breast implants: anaplastic large-cell lymphoma, late seromas, and double capsules. Gland Surg. Apr. 2017;6(2):169–184.
doi: 10.21037/gs.2016.11.03. PMID: 28497021; PMCID: PMC5409903.
28 Piubelli MLM, Ferrufino-Schmidt MC, Miranda RN. Gluteal Implant-Associated Anaplastic Large Cell Lymphoma (ALCL) is Distinct from Systemic ALCL ALK Negative in a Patient with Gluteal Implants. Aesthetic
Surg J. 2019;39(10):NP441–NP442. doi: 10.1093/asj/sjz197.
29 Medical Device Reports of Breast Implant-Associated Anaplastic Large Cell Lymphoma | FDA. Zugriff am 28. Februar 2022. https://www.fda.gov/medical-devices/breast-implants/medical-device-reports-breast-implant- associated-anaplastic-large-cell-lymphoma
30 Doren EL, Miranda RN, Selber JC et al. U.S. Epidemiology of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Plastic and reconstructive surgery. 2017;139(5):1042-1050. doi:10.1097/PRS.0000000000003282
31 Cordeiro PG, Ghione P, Ni A et al. Risk of breast implant associated anaplastic large cell lymphoma (BIA-ALCL) in a cohort of 3546 women prospectively followed long term after reconstruction with textured breast implants. Journal of plastic, reconstructive & aesthetic surgery: JPRAS. 2020;73(5):841–846. doi:10.1016/J. BJPS.2019.11.064
32 Nelson JA, Dabic S, Mehrara BJ et al. Breast Implant-associated Anaplastic Large Cell Lymphoma Incidence: Determining an Accurate Risk. Annals of surgery. 2020;272(3):403–409. doi:10.1097/SLA.0000000000004179
33 Loch-Wilkinson A, Beath KJ, Knight RJW et al. Breast Implant-Associated Anaplastic Large Cell Lymphoma in Australia and New Zealand: High-Surface-Area Textured Implants Are Associated with Increased Risk. Plastic and reconstructive surgery. 2017;140(4):645–654. doi:10.1097/PRS.0000000000003654
34 Matros E, Shamsunder MG, Rubenstein RN et al. Textured and Smooth Implant Use Reported in the Tracking Operations and Outcomes for Plastic Surgeons Database: Epidemiologic Implications for BIA-ALCL. Plastic and Reconstructive Surgery Global Open. 2021;9(3). doi:10.1097/GOX.0000000000003499
35 Ye X, Shokrollahi K, Rozen WM, et al. Anaplastic large cell lymphoma (ALCL) and breast implants: breaking down the evidence. Mutation research/Reviews in mutation research. 2014;762:123–132. doi:10.1016/ J.MRREV.2014.08.002