Gebrauchsinformationen/Beipackzettel für Brustimplantate von Eurosilicone mit Silikongel gefüllt.
BESCHREIBUNG
Die mit Gel gefüllten Mammaimplantate sind zur kosmetischen Mammaaugmentation oder zur Rekonstruktion der Brust bestimmt und sind in runden oder anatomischen Formen erhältlich. Die Hülle aus Silikonelastomer kann glatt oder mit einer strukturierten Oberfläche versehen sein, die durch ihre Unregelmäßigkeit eine gute Kontaktoberfläche für das Collagen bietet, und ist mit einem kohäsiven oder hoch-kohäsivem Gel gefüllt.
INDIKATIONEN
Die gelgefüllten Brustimplantate Eurosilicone sind für die folgenden Verfahren indiziert:
- Kosmetische Augmentationsplastik
- Augmentation und Korrektur der Körperkontur bei kongenitalen Fehlbildungen der Brust
- Rekonstruktion der Brust nach subkutaner Mastektomie und anderen in Frage kommenden Mastektomie-Eingriffen oder Traumata
- Kombinierte Fehlbildungen der Brust und Thoraxwand
- Ersatz von Implantaten aus medizinischen und kosmetischen Gründen
KONTRAINDIKATIONEN
Die Verwendung dieser Implantate ist bei Patientinnen kontraindiziert, die an einer oder mehreren der folgenden Erkrankungen oder Zustände leiden:
- FIBROZYSTISCHE Erkrankung
- UNGENÜGENDE GEWEBEDECKUNG aufgrund von Strahlungsschädigung der Thoraxwand, enge Thoraxhauttransplantate oder radikale Resektion des M. pectoralis major
- BESTEHENDES LOKALES ODER METASTATISCHES MAMMAKARZINOM
- Geschwächtes Immunsystem/Immunsuppression
- Anamnestisch bekannte Empfindlichkeit gegenüber Fremdstoffen oder Atopie oder NICHT ZUFRIEDEN STELLENDE Augmentation / Rekonstruktion in der Anamnese
- Mangelnde PHYSIOLOGISCHE / PSYCHOLOGISCHE Eignung der Patientin
- AKTIVE INFEKTION eines Körperbereichs
- Kürzere Zeit zurückliegender Mammaabszess
- Anamnestisch schlechte Wundheilung oder regionale Schwellung
- Anderer schwerwiegender medizinischer Befund
- Diese Produkte sind nicht für die Behandlung von Kindern, schwangeren oder stillenden Frauen vorgesehen
WICHTIG: Der Chirurg muss die nötigen medizinischen Beurteilungen vornehmen, um zu entscheiden, ob eine Implantation bei der Patientin angezeigt ist, und die für die jeweilige Patientin geeignetste Operationstechnik und das geeignete Implantat wählen.
Die Brustimplantation wirkt sich normalerweise positiv auf die psychische Verfassung der Patientinnen aus. Wie bei allen medizinischen Eingriffen können jedoch auch hier Komplikationen auftreten. Vor der Im- plantation muss der Chirurg der Patientin sämtliche in dieser Anleitung enthaltenen Informationen zur Verfügung stellen und sicherstellen, dass sie sämtliche Begriffe verstanden hat und ihre Einwilligung einholen. Der Chirurg muss die Patientin über das Verhältnis der Vorteile zu den Risiken dieses Eingriffs informieren. Jede mögliche Komplikation und sämtliche Warnhinweise müssen vor der Operation besprochen werden. Die Patientin muss darüber informiert werden, dass die Implantate eine begrenzte Lebensdauer haben und dass nach Einsetzen eines Implantats dessen Entfernung bzw. Ersatz nötig werden kann, was einen erneuten chirurgischen Eingriff zur Folge hat.
Die klinische Nachverfolgung der Eurosilikon-Implantate hat bisher eine Beständigkeit der Implantate zu 82.4% nach 10 Jahren ergeben (Risiko einer ersten Folgeoperation = 17.6%, Methode Kaplan Meier). Vor einer Mammografie muss der Röntgenarzt über das Vorhandensein eines Implantats informiert werden, damit er die Kompression entsprechend anpassen kann.
Vor jedem chirurgischen Eingriff im Brustbereich muss der Chirurg oder Arzt über das Implantat informiert werden.
Vor jeder lokalen Anwendung von Arzneimitteln (wie Steroide) im Brustbereich muss ein Arzt oder Apotheker konsultiert werden.
Das Vorhandensein von Brustimplantaten kann ggf. die Erkennung von Brustkrebs durch Selbstuntersuchung verzögern. Daher muss die Patientin informiert werden, dass sie ihren Chirurgen und/oder Arzt für die entsprechende Nachkontrolle sowie eine regelmäßige Untersuchung der Brust auf Krebs aufsuchen muss. Die Patientin muss außerdem informiert werden, dass sie bei jeglichem Verdacht auf Komplikationen einen Arzt aufsuchen muss, insbesondere bei Verletzungen oder Schlägen, wie etwa bei einer starken Brustmassage, bei sportlichen Aktivitäten oder durch Sicherheitsgurte.
Nach der Operation übergibt der Arzt der Patientin die Identifikationskarte des Produkts, welche sie immer bei sich tragen muss, um ggf. die Behandlung durch Notärzte zu erleichtern.
N.B.: Obwohl die Implantate von Eurosilicone nicht speziell auf die Kompatibilität mit einer MRT getestet wurden, möchten wir darauf hinweisen, dass alle mit Gel gefüllten Brustimplantate von Eurosilicone aus medizinisch für Implantate geeignetem Silikonmaterial hergestellt wurden, das mit MRTs kompatibel ist. Das Silikon-Implantatmaterial ist dasselbe, das auch für andere Silikonimplantate von Eurosilicone verwendet wird, mit denen sich Patienten bereits einem MRT unterzogen haben, ohne dass bisher Kompatibilitätsprobleme gemeldet wurden.
MÖGLICHE KOMPLIKATIONEN UND WARNHINWEISE
Folgende mögliche Komplikationen können in Verbindung mit den gelgefüllten Mammaimplantaten auftreten:
Weitere mögliche Komplikationen, die bei allen chirurgischen Eingriffen auftreten können, sollten ebenfalls mit der Patientin besprochen werden. Hierzu gehören, wenngleich nicht ausschließlich: Infektionen (siehe unten), Hämatome (siehe unten), Ansammlungen seröser Flüssigkeit (siehe unten); Gefühlsverlust (siehe unten); Reaktion auf Medikamente; Nervenschädigung; Abstoßung des Fremdimplantats und schlechte Wundheilung.
KAPSELKONTRAKTUR
Die Kapselfibrose ist eine häufige Komplikation bei Mammaimplantaten. Die Bildung einer fibrösen Gewebekapsel rund um das Implantat ist eine normale physiologische Reaktion auf den Fremdkörper; nicht bei allen Kapseln kommt es zur Kontraktur. Die Kontraktur des fibrösen Kapselgewebes rund um das Implantat kann zu Verhärtungen, Beschwerden und Schmerzen in der Brust, Verformung der Brust, Tastbarkeit des Implantats oder zur Verlagerung der Implantats führen. Die Ursache der Kapselkontraktur ist unklar, hier dürften jedoch verschiedene Faktoren eine Rolle spielen. Die Kontrakturen können unterschiedlich stark ausgeprägt sein und ein- oder beidseitig innerhalb von Wochen oder Jahren nach der Operation auftreten. In schweren Fällen ist unter Umständen ein chirurgischer Eingriff erforderlich. Nach der Kapseleröffnung oder -entfernung kann eine erneute Kapselkontraktur auftreten. Knoten, die mit kapsulären Narbenbildungen verwechselt werden, können die Diagnose eines tastbaren Tumors verzögern. Im Zweifelsfall müssen Knoten daher unverzüglich untersucht werden.
KALKEINLAGERUNGEN
Die Verkalkung des Brustgewebes mit zunehmendem Alter ist ein natürlicher Vorgang, der unabhängig vom Vorliegen eines Implantats stattfindet. Verkalkungen des Brustgewebes können auch nach der Implantation von Fremdkörpern auftreten; die Ursache hierfür ist nicht geklärt, und die Zahl der berichteten Fälle ist gering. Mikrokalzifikationen treten nach Implantationen normalerweise an der oder rund um die fibröse Kapsel auf und haben die Form von dünnen Plaques oder Kalkansammlungen. Ausgedehnte Mikrokarzifikationen können zur Verhärtung der Brust und zu Beschwerden führen und erfordern unter Umständen einen chirurgischen Eingriff.
EXTERNE KAPSELERÖFFUNG
Eine manuelle Sprengung der Kapselkontraktur von außen kann zu einer Schwächung oder einer Ruptur der Hülle führen. Rupturen wurden mehrfach berichtet. Eurosilicone rät daher von einer externen Kapseleröffnung ab und übernimmt keine Verantwortung für die Unversehrtheit des Implantats, wenn manuelle Kompressions- oder andere Techniken mit externer Krafteinwirkung verwendet werden.
RUPTUR VON GELIMPLANTATEN
Eine Ruptur von Gelimplantaten kann nach der Operation aufgrund einer Beschädigung des Implantats beim Umgang mit dem Produkt oder bei der Operation auftreten. Eine Ruptur der Hülle kann auch durch eine Kontraktur, ein Trauma oder übermäßige Manipulation auftreten. Es wurde auch über Rupturen unbekannter Ursache berichtet. Aufgrund der Festigkeit des Gelmaterials können Rupturen von Gelimplantaten auch unbemerkt bleiben, bis aus einem anderen Grund eine Operation durchgeführt wird (z.B. Änderung der Größe). Trotz der kohäsiven Eigenschaften des Gels kann es unter Druck zu einer Extravasation aus der Prothesentasche kommen; in diesem Fall kann eine zusätzliche Operation erforderlich sein, um das Gel zu entfernen. Über Entzündungen und die Bildung von Silikongranulomen wurde berichtet. Wenn ein Verdacht auf eine Ruptur der Implantathülle besteht, muss das Implantat entfernt werden.
INFEKTION
Vorbestehende Infektionen, die nicht vor der Einbringung des Implantats ausgeheilt ist, erhöhen das Risiko einer perioprothetischen Infektion. Darauf achten, dass das Implantat und Füllzubehör nicht mit Kontaminanten in Kontakt kommen, die das Infektionsrisiko erhöhen.
Infektionen stellen bei jedem invasiven Eingriff ein Risiko dar. Infektionen im Bereich von Mammaimplantaten können Tage, Wochen oder sogar Jahre nach der Operation auftreten. Zu den berichteten Anzeichen einer akuten Infektion bei Mammaimplantaten gehören Erytheme, Berührungsschmerzhaftigkeit, Flüssigkeitsansammlungen, Schmerzen und Fieber. Die Zeichen einer subklinischen Infektion sind möglicherweise nur schwer erkennbar. Postoperative Infektionen sollten nach allgemeiner medizinischer Praxis aggressiv behandelt werden, um schwerere Komplikationen zu vermeiden. Bei therapiere- sistenten oder nekrotisierenden Infektionen ist unter Umständen eine Entfernung des Implantats erforderlich. Kapselkontrakturen können mit einer Infektion im Bereich rund um das Implantat verbunden sein.
GRANULOM
Die Entstehung von Granulomen ist eine bekannte Gewebsreaktion auf das Vorhandensein von Fremdkörpern. Es ist möglich, dass körpereigenes Gewebe auf das Implantat reagiert und Silikongranulome ausbildet.
HÄMATOME / SEROME
Hämatome und Ansammlungen seröser Flüssigkeiten sind Komplikationen, die bei jedem invasiven Eingriff auftreten können. Postoperative Hämatome und Serome können zu Infektionen bzw. zur Ka- pselkontraktur beitragen. Die Gefahr von postoperativen Hämatomen und Seromen kann durch sorgfältige Hämostase während der Operation und durch eventuelle postoperative Verwendung eines geschlossenen Drainagesystems verringert werden. Übermäßige persistierende Blutungen müssen vor der Implantation gestillt werden. Eine postoperative Entleerung von Hämatomen oder Seromen muss vorsichtig erfolgen, um eine Kontamination oder Beschädigung des Implantats zu vermeiden.
EXTRUSION
Eine instabile oder beeinträchtigte Gewebedeckung und / oder Unterbrechung der Wundheilung kann zur Exposition und Extrusion des Implantats führen. Zu den Ursachen bzw. Einflussfaktoren gehören Infektionen, Wunddehiszenz, infektiöse oder nichtinfektiöse Nekrose, Kapselkontraktur, externe Kapseleröffnung, ungeeigneter Hautlappen, falsche Größe und Platzierung des Implantats bzw. Gewebeero- sion durch Implantatfalten. Extrusionen treten vermehrt dann auf, wenn das Implantat in Verletzungsgebieten implantiert wurden: in vernarbtem, stark bestrahltem oder verbranntem Gewebe oder Gebieten mit Knochentrümmern; wenn im Implantationsgebiet eine starke chirurgische Reduktion vorgenommen wurde; und bei Einbringung von Steroiden in die Prothesentasche.
FÄLTCHEN- UND FALTENBILDUNG
Dünnes oder mangelhaftes darüber liegendes Gewebe, wenig oder kein Unterhautfettgewebe, die Wahl eines zu großen Implantats für die Prothesentasche oder die Statur der Patientin und eine subkutane Platzierung können zu tastbaren oder sichtbaren Fältchen und Falten führen. Eine Faltenbildung kann zur Verdünnung und Erosion des benachbarten Gewebes und zur Erosion des Implantats führen. Anzeichen von Hautentzündungen wie Berührungsschmerzhaftigkeit und Erytheme können auf eine Verdünnung oder Erosion der Haut hinweisen und müssen umgehend untersucht werden. Tastbare Fältchen bzw. Falten können mit tastbaren Tumoren verwechselt werden; in Zweifelsfällen ist daher eine umgehende Untersuchung angezeigt.
EMPFINDUNG
Das Risiko einer zeitweisen oder dauerhaften Dysästhesie besteht bei jedem invasiven Eingriff. Durch eine umsichtige Operationstechnik kann dieses Risiko verringert, jedoch nicht ausgeschlossen werden. Über eine zeitweise oder dauerhafte Dysäthesie im Mamillen-/Areolenbereich und in selteneren Fällen in der gesamten Brust nach Implantationen wurde berichtet. Die Gefahr von neurologischen Schäden nimmt mit umfangreicheren Eingriffen zu. Implantierte Mammaimplantate können die Stillfähigkeit beeinträchtigen. Die eigentliche Ursache hierfür kann jedoch auch die vorangegangene Rekonstruktion der Brust sein.
BEEINTRÄCHTIGUNG DER MAMMOGRAPHIE
Standardeinstelltechniken haben signifikante Grenzen gezeigt, wenn sie für die Darstellung nach Brustaugmentation eingesetzt werden. Das Implantat kann den Nachweis von Brustkrebs im Frühstadium durch Mammographie dadurch beeinträchtigen, dass das darunter liegendes Brustgewebe verdeckt wird und / oder das darüber liegende Gewebe komprimiert wird, wodurch verdächtige Läsionen in der Brust ‚versteckt ‘sein können. Die Patientinnen sollten angehalten werden, Radiologen aufzusuchen, die Erfahrung mit den neuesten Radiologietechniken und -geräten für die Darstellung von Brüsten mit Implantaten haben, und ihre Radiologen über das Vorliegen, die Art und die Platzierung der Implantate zu informieren, und, wenn es sich um anatomische Implantate handelt, sollten sie sich der Markierungen zur Ausrichtung auf den anatomischen Implantaten bewusst sein.
UNZUFRIEDENHEIT MIT DEM ERGEBNIS
Die Wahl der falschen Implantatgröße, eine ungeeignete Narbenposition, hypertrophes Narbengewebe und die nachfolgend aufgeführten weiteren Komplikationen stehen meist im Zusammenhang mit der Operationstechnik. Die sorgfältige Auswahl der richtigen Implantatgröße, die Schaffung einer hinreichend großen, passenden Prothesentasche und die Wahl einer aktuellen, anerkannten Operationstechnik liegen in der Verantwortung des Chirurgen.
VERLAGERUNG DES IMPLANTATS
Implantate können sich verlagern; die Folgen sind Unbehagen bzw. eine Verformung der Brust. Die Gefahr einer Verlagerung erhöht sich durch die Verwendung schwieriger Plazierungstechniken, bei denen eine relativ kleine Prothesentasche verwendet wird und die Genauigkeit der Platzierung eingeschränkt ist. Bei Verlagerung des Implantats kann eine operative Korrektur erforderlich sein.
ASYMMETRIE
Zur Asymmetrie von Brustimplantaten kann es durch ungeeignete Erstplatzierung, Verlagerung oder durch unterbliebene Korrektur einer vorbestehenden Asymmetrie durch individuelle Variation der Implan- tatgröße kommen. Vorbestehende Asymmetrien lassen sich nicht immer vollkommen korrigieren. Asymmetrien können auch ein Anzeichen für Kapselkontraktur, Flüssigkeitsansammlungen, Infektionen, postoperative Dysplasie der Brust, einseitig unterschiedliche Muskelentwicklung oder Deflation sein und bedürfen der weiteren Untersuchung.
VERWENDUNG VON MEDIKAMENTEN
Eurosilicone kann keine Sicherheitsprognose oder -garantie geben, wenn Arzneimittel, wie z.B. Anästhetika, Steroide, Antibiotika oder Vitaminlösungen intraluminal eingebracht werden. Vor einer solchen Einbringung ist der Hersteller des Arzneimittels zu konsultieren.
ERKLÄRUNG VON MAMMAIMPLANTATEN
Wenngleich hierzu keine definitiven Berichte in der ärztlichen Fachliteratur vorliegen, ist davon auszugehen, dass viele Mammaimplantate zu einem späteren Zeitpunkt chirurgisch explantiert oder aus- gewechselt werden müssen. Dies ist auch bei vielen anderen chirurgischen Prothesen der Fall, die häufig erneuert werden müssen, um die fortgesetzte Zufriedenheit des Patienten zu gewährleisten. Wegen der sehr verschiedenen körperlichen Reaktionen der Patientinnen auf Brustimplantate, Unterschieden in der Operationstechnik und der ärztlichen Behandlung und möglichen Komplikationen sollten die Patientinnen darauf hingewiesen werden, dass die Prothesen nicht als lebenslange Implantate betrachtet werden sollten und dass eine chirurgische Explantation jederzeit nötig werden kann. Eurosilicone übernimmt keine Garantie für die Implantationsdauer des Implantats.
SILIKONALLERGIE
Silikonallergien sind zwar extrem selten, dennoch kann das Risiko nicht vollständig ausgeschlossen werden.
STILLEN
Die Implantation kann die Milchproduktion während des Stillens beeinträchtigen, insbesondere kann eine periareoläre Inzision die Möglichkeit des Stillens erheblich herabsetzen.
SCHMERZEN
Schmerzen unbekannter Genese, die nicht mit den hier beschriebenen Komplikationen in Zusammenhang stehen, bedürfen der umgehenden Untersuchung.
ANAPLASTISCH-GROSSZELLIGES LYMPHOM
In Sicherheitshinweisen für Europa, Dokumenten der amerikanischen Arzneimittelaufsicht FDA und aktuellen wissenschaftlichen Studien wird auf einen möglichen Zusammenhang zwischen Brustimplantaten und dem seltenen Auftreten anaplastischer großzelliger Lymphome (ALCL), einer Unterart der Hodgkin-Lymphome, hingewiesen. Frauen mit Brustimplantaten haben demnach möglicherweise ein geringes, jedoch im Vergleich zu Frauen ohne Implantate höheres Risiko, an einem ALCL im Gewebe in Implantatnähe zu erkranken. Dieser Sachverhalt wird in der WHO-Klassifizierung 2016 unter dem Begriff „ALCL
– AIM“ geführt. In diesem Sicherheitshinweis wird von einer sehr kleinen Zahl Fälle berichtet, in denen in der Flüssigkeit oder im Gewebe um Implantate Krebszellen festgestellt wurden. Die Hauptsymptome, die bei Frauen mit ALCL und Brustimplantaten auftraten, sind langanhaltende Schwellungen oder Schmerzen, spät auftretende und langfristig feststellbare Serome in der Umgebung des Implantats, Kapselkontraktur und Raumforderungen in der Implantatumgebung.
Im Jahr 2011 berichtete die FDA, dass trotz des erhöhten ALCL-Risikos für Frauen mit Brustimplantaten die Zahlen der Erkrankungsfälle so gering ausfallen, dass ein Zusammenhang nicht sicher nachgewiesen werden kann. Dieser Hinweis wurde 2016 um weitere Informationen zu ALCL sowie um Empfehlungen zur Untersuchung auf diese seltene Erkrankung und deren Behandlung ergänzt. Sollten Frauen an den oben beschriebenen Symptomen leiden oder ein Verdacht auf ALCL bestehen, wird empfohlen, die Patientinnen zu untersuchen, um ein ALCL in Implantatnähe auszuschließen. Für die Untersuchung auf ALCL frische Seromflüssigkeit sowie repräsentative Proben der Kapsel nehmen und diese zur pathologischen Untersuchung schicken, um eine ALCL-Erkrankung auszuschließen. Für die Diagnose sollte eine zytologische Untersuchung der Seromflüssigkeit unter Zuhilfenahme eines Ausstrichs mit Wright-Giemsa-Färbung und Zellblock-Immunhistochemie durchgeführt werden, bei der nach einem Cluster of Differentiation (CD) und Markern für anaplastische Lymphomkinase (ALK) gesucht wird. Meist wird ein durch Brustimplantate verursachtes ALCL durch Explantation des Implantats sowie der umliegenden Kapsel behandelt, es wurden in der Vergangenheit aber auch Behandlungen mit Chemotherapie und Bestrahlung durchgeführt. Sollte eine Ihrer Patientinnen an ALCL erkranken, wenden Sie sich unter folgender E-Mail-Adresse an Eurosilicone: return@gcaesthetics.com. Individuelle Behandlungsregimes sollten von einem disziplinübergreifenden Ärzteteam aufgestellt werden.
GEBRAUCHSANWEISUNG OPERATIONSVERFAHREN
Die Wahl der korrekten Operationsverfahren und -techniken liegt in der ärztlichen Verantwortung. Der Chirurg muss die Eignung des gewählten Verfahrens anhand aktueller anerkannter Techniken, seines persön-
lichen Urteilsvermögens und seiner Erfahrung beurteilen. Die geeignete Größe und Form der Implantate muss vom Chirurgen individuell für jede Patientin bestimmt werden. Die Länge der Inzision muss für die Art, die Größe und das Profil des Implantats geeignet sein. Dies verringert die Gefahr einer übermäßigen Beanspruchung des Implantats während der Einbringung.
BESONDERE RICHTLINIEN FÜR DIE VERWENDUNG VON EUROSILICONE MAMMAIMPLANTATEN
- Die Größe sollte entsprechend den Maßen der Implantatbasis, den Maßen der Patientin und den individuellen Merkmalen der Brust und nicht nach dem bevorzugten Volumen oder der bevorzugten Projektion ausgewählt werden.
- Die vorgeformten Eurosilicone Implantate sind fester als andere mit kohäsivem Gel gefüllte Implantate und die Inzision sollte länger sein als bei komprimierbaren Implantaten.
- Gegebenenfalls muss die neue Unterbrustfalte ca. 1 cm unter der natürlichen Falte liegen.
- Empfohlen wird der Zugang über die Unterbrustfalte. Die Entscheidung, ob eine axilläre oder transareoläre Platzierung möglich ist, liegt in der Verantwortung des Chirurgen. Es wirddarauf hingewiesen,dass die Einbringung und Ausrichtung aufgrund der erhöhten Festigkeit des Gels schwieriger sein können.
- Falls möglich, ist eine Platzierung unter dem Muskel (mit möglicher Lösung des unteren Bandes) zu bevorzugen. Da das Gel sehr kohäsiv ist, hat es einen definierteren Radius amoberen Rand der Spitze. Eine Platzierung unter dem Muskel verringert die Gefahr, dass dieser Radius tastbar ist.
- Eurosilicone Implantate NICHT mit übermäßigem Kraftaufwand platzieren. Eine zu starke Manipulation der Eurosilicone Implantate kann zu einer dauerhaften Verformung des kohäsiven Gels und zu einem Formverlust des Implantats führen.
- Die Aufrechterhaltung der korrekten Ausrichtung und Vermeidung der Rotation nach der Operation wird unterstützt durch:
a) eine genau an das Implantat angepasst Prothesentasche
b) eine „trockene“ Prothesentasche
c) Ausführung des Verfahrens der Implantatstabiliserung durch postoperative externe - Alle Mammaimplantate können sich in der unmittelbaren postoperativen Phase möglicherweise drehen und die Richtlinien oben tragen dazu bei, dies bei anatomisch geformten I m – plantaten zu vermeiden.
- EINE KORREKTE AUSRICHTUNG IST WESENTLICH, wenn eine anatomische Form der Eurosilicone Implantate verwendet wird, da die konische Form dieser Implantate eine Spitze aufweist. Diekorrekte Ausrichtung während der Implantation wird durch die nachstehend beschriebenen Markierungen unterstützt.
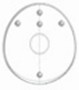
TM F1-3, TM M1-3, TM L1-3
Auf der oberen und hinteren Fläche des Implantats sind tastbare Orientierungsmarkierungen angebracht. Zur Positionierung der Markierungen siehe Schemadiagramm unten. Schematische Darstellung der Markierungen für die korrekte Ausrichtung.
STERILITÄT
Die Implantate werden steril geliefert (Ethylenoxidsterilisierung). Die Sterilisierung erfolgt mit streng kontrollierten, validierten Sterilisationsverfahren mit Ethylenoxid. Die Sterilität wird anhand standardisierter Techniken geprüft. Die Sterilität des Implantats ist nur gewährleistet, solange die Verpackung intakt und unbeschädigt ist. Benutzen Sie NIEMALS ein Implantat dessen sterile Verpackung beschädigt ist.
EINMALIGER GEBRAUCH
Diese Implantate sind nur zum EINMALIGEN GEBRAUCH bestimmt. EXPLANTIERTE PROTHESEN DÜRFEN NICHT WIEDERVERWENDET WERDEN. DIE PRODUKTE DÜRFEN NICHT RESTERI- LISIERT WERDEN. Explantierte Produkte dürfen nicht wiederverwendet werden, da durch die erneute Reinigung und Sterilisierung keine ausreichende Entfernung von biologischen Rückständen wie Blut, Gewebe und anderen Substanzen gewährleistet ist, die resistente Erreger enthalten können, und die Leistungsfähigkeit des Implantats beeinträchtigt werden kann.
VERPACKUNG
Das Produkt wird steril in einer versiegelten, doppelten Erstverpackung geliefert. Bei beschädigter oder geöffneter Verpackung ist die Sterilität des Produkts nicht mehr gewährleistet. An der Primärverpackung sind Abreißetiketten für die Patientenakte angebracht. Diese Etiketten sind in die Patientenakte einzukleben.
LAGERBEDINGUNGEN
Eurosilicone-Produkte müssen unter normalen Bedingungen, vor Feuchtigkeit und direktem Sonnenlicht geschützt und mit den Pfeilen nach oben gelagert werden. Unter diesen Bedingungen haben Eurosilicone-Produkte eine Haltbarkeitsdauer von fünf Jahren.
ÖFFNEN DER STERILEN PRODUKTVERPACKUNG
- Die äußere Verpackung unter saubere, aseptischen Bedingungen über dem sterilen Feld aufziehen und die versiegelte innere Verpackung vorsichtig in das sterile Feld fallen lassen.
- Das am Innenbeutel angebrachte Etikett in die Patientenakte einkleben.
- Die Innenverpackung unter aseptischen Bedingungen aufziehen.#
PRÜFUNG UND HANDHABUNG DES PRODUKTS
- Das Produkt einer Sichtkontrolle auf Anzeichen von Partikelkontaminationen, Beschädigungen und Lecks unterziehen.
- Das Implantat bis zur Implantation in steriles Wasser oder normale Kochsalzlösung tauchen, um den Kontakt mit partikulären Kontaminanten in der Luft oder im Operationsfeld zu verhindern.
- Das Implantat nicht in Lösungen tauchen, die Betadine oder Jod enthalten. Wenn Lösungen mit Betadine oder Jod in der Prothesentasche verwendet werden, ist sicherzustellen, dass diese gründlich gespült wird, so dass keine Restlösung in der Tasche verbleibt.
- Mit Gel gefüllte Mammaimplantate können Luftbläschen enthalten. Diese entstehen normalerweise während der Sterilisierung und hat keine Auswirkung auf die Unversehrtheit oder die Leistungsfähigkeit des Produktes.
KONTAMINATION DER IMPLANTATE
Die Implantate müssen sorgfältig gehandhabt werden, um jeden Kontakt mit Oberflächenkontaminanten wie Talkumpuder, Staub und Hautfett zu verhindern. Die Produkte müssen vor der Implantation auf Kontaminationen überprüft werden. Eine Kontamination bei der Operation erhöht das Risiko periprosthetischer Infektion und möglicherweise von Kapselkontrakturen.
Strukturierte Silikonoberflächen sind potentiell anfälliger für Kontaminationen als glatte Silikonoberflächen. Besondere Sorgfalt ist bei der Handhabung von Implantaten mit strukturierter Oberfläche geboten. Eurosilicone übernimmt keine Verantwortung für Kontaminationen durch andere Substanzen, die auftreten, nachdem das Produkt unser Haus verlassen hat.
OBERFLÄCHENKONTAMINANTEN (TALKUMPUDER, STAUB, FASTERN, ÖL) AUF DER OBERFLÄCHE VON IMPLANTATEN KÖNNEN FREMDKÖRPERREAKTIONEN AUSLÖSEN. IMPLAN- TATE NUR MIT OPERATIONSHANDSCHUHEN (VON DENEN DER TALKUMPUDER ABGESPÜLT WURDE) UNTER STRENG ASEPTISCHEN BEDINGUNGEN HANDHABEN. KONTAMINISERTE PRODUKTE NICHT IMPLANTIEREN. Für den Fall einer Kontamination müssen stets Reserveimplantate bereitgehalten werden.
BESCHÄDIGUNG DES IMPLANTATS – BESCHÄDIGUNG WÄHREND DER OPERATION
Bei der Handhabung des Implantats sollte äußerste Vorsicht angewendet werden, um die Gefahr einer Beschädigung der Hülle möglichst gering zu halten. Alle Implantate werden mit üblichen Fertigung- stechniken unter strenger Qualitätskontrolle hergestellt, eine Beschädigung der Implantate bei der Handhabung oder während der Operation (bei der Erstoperation und späteren Operationen) ist jedoch nicht auszuschließen. Äußerste Vorsicht ist geboten, um einen Kontakt mit scharfkantigen Gegenständen wie chirurgischen Instrumenten, Nähnadeln und Subkutannadeln zu vermeiden. Unnötige Handhabung mit stumpfen Instrumenten und Manipulation vermeiden. Die strukturelle Unversehrtheit der Prothese muss vor der Implantation sorgfältig kontrolliert werden. Beschädigte Implantate dürfen nicht implantiert werden; nicht versuchen, beschädigte Implantate zu reparieren. Für den Fall einer Beschädigung oder Kontamination müssen während der Operation stets Reserveimplantate bereitgehalten werden. Die Empfehlungen für die Prüfung, Untersuchung und Handhabung der Implantate müssen genau beachtet werden, um eine korrekte Verwendung der Implantate zu gewährleisten. Die Patientin sollte ange- halten werden, andere behandelnde Ärzte über das Implantat zu informieren, um die Gefahr einer Beschädigung zu verringern.
RUPTUR DER IMPLANTATE IN DER PROTHESENTASCHE
Wenn dies auftritt, kann man mit dem Zeigefinger der mit zwei Handschuhen geschützten Hand in die Gelmasse fassen und gleichzeitig mit der anderen Hand Druck auf die Brust ausüben. Das Gel kann in der Hand aus der Höhle entfernt werden und dann kann der äußere Handschuh zur Entsorgung über die Masse gezogen werden. Die Prothesentasche mit Gazetupfern abtupfen. Mit Isopropylalkohol kann Gel von den Instrumenten entfernt werden.
VERÄNDERUNG DER IMPLANTATE
An den Mammaimplantaten dürfen vor der Implantation keine Veränderungen vorgenommen werden. Eine Veränderung der Implantate führt zum Erlöschen aller ausdrücklichen oder implizierten Garantien.
ENTSORGUNG VON IMPLANTATEN
Alle Mammaimplantate müssen gemäß den Anforderungen für medizinische Abfälle mit Infektionsrisiko entsorgt werden.
RÜCKGABE
Vor der Rückgabe eines Produktes:
a) müssen die Product File Notes ausgefüllt
b) Mit jedem zurückgesendeten Produkt, das aus der Packung genommen wurde, muss eine Dekontaminationsbescheinigung mitgeliefert
c) Falls zur sicheren Dekontamination / Sterilisation eine Punktion der Hülle eines versiegelten Produktes erforderlich ist, sollte die Oberfläche des Produkts an der Stelle, an der eine mechanische Einwirkung stattgefunden hat, mit einem Permanentmarker gekennzeichnet werden und ein entsprechender Vermerk auf der Dekontaminationsbescheinigung eingetragen werden.
d) Die Products File Notes und die zurückgegebenen Produkte dürfen nur von Ihrem Vertreter an Eurosilicone S.A.S. gesendet werden.
GARANTIE
Der Hersteller garantiert, dass diese Produkte mit angemessener Sorgfalt hergestellt wurden, und ersetzt Produkte, die nach Prüfung des Herstellers zum Zeitpunkt des Versands defekt waren. Die Auswahl der Patienten, die Operationstechnik, die postoperative Behandlung und Belastung und die Handhabung der Produkte liegen vollkommen in der Verantwortung des Kunden. Eurosilicone hat keinen Einfluss auf die Bedingungen, unter denen das Produkt benutzt wird, und kann keine Garantie für Nutzen oder gegen Schäden geben, die durch die Benutzung dieses Produkts entstehen können, und übernimmt keine Haftung für beiläufig entstandene oder Folgeschäden oder Unkosten, die direkt oder indirekt aus der Benutzung dieser Produkte erwachsen. Alle anderen Garantien (auch durch Gesetz oder ander- weitig implizierte) werden im maximalen dem Gesetz nach zulässigen Umfang ausgeschlossen.
ACHTUNG:
Nach US-amerikanischer Bundesgesetzgebung darf dieses Produkt nur durch einen Arzt oder auf Anweisung eines Arztes verkauft werden.
LITERATUR
Literaturangaben können auf Anfrage von Eurosilicone bezogen werden.