Cyklokapron®-Injektionslösung Beipackzettel
1. BEZEICHNUNG DES ARZNEIMITTELS
Cyklokapron®-Injektionslösung
500 mg/5 ml
1 000 mg/10 ml
Injektions-/ Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Injektionslösung enthält 100 mg Tranexamsäure. Jede Ampulle mit 5 ml Injektionslösung ent- hält 500 mg Tranexamsäure. Jede Ampulle mit 10 ml Injektionslösung enthält 1 000 mg Tranexamsäure. Vollständige Auflistung der sonstigen Be- standteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektions-/Infusionslösung
Klare, farblose Lösung mit einem pH-Wert von 6,5 bis 8,0.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Tranexamsäure ist indiziert für Erwachsene und Kinder ab 1 Jahr zur Prophylaxe und Behandlung von Blutungen aufgrund einer lokalen oder generalisierten Hyperfibrinolyse. Die genauen Anwendungsgebiete umfassen:
- Blutungen aufgrund einer lokalen oder generalisierten Hyperfibrinolyse, wie z. B.
- Menorrhagie und Metrorrhagie,
- gastrointestinale Blutungen,
- Blutungen bei Harnwegserkrankungen, nach Prostataoperationen oder Operationen am Harntrakt
- Hals-, Nasen-, Ohrenoperationen (Adenotomie, Tonsillektomie, Zahnextraktionen),
- gynäkologische Operationen oder geburtshilfliche Blutungen,
- Operationen am Thorax und Bauchraum sowie andere größere chirurgische Eingriffe wie z. B. kardiovaskuläre Operationen,
- Blutungen unter fibrinolytischer Therapie.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene
Soweit nicht anders verordnet, gelten folgende Dosierungsempfehlungen:
- Standarddosierung bei lokaler Fibrinolyse:
0,5 g (1 Ampulle à 5 ml) bis 1 g (1 Ampulle à 10 ml oder 2 Ampullen à 5 ml) Tranexamsäure als langsame intravenöse Injektion oder Infusion (= 1 ml/Minute) zwei- bis dreimal täglich - Standardtherapie bei generalisierter Fibrinolyse:
1 g (1 Ampulle à 10 ml oder 2 Ampullen à 5 ml) Tranexamsäure als langsame intravenöse Injektion oder Infusion (= 1 ml/ Minute) alle 6 bis 8 Stunden, entsprechend 15 mg/kg Körpergewicht (KG)
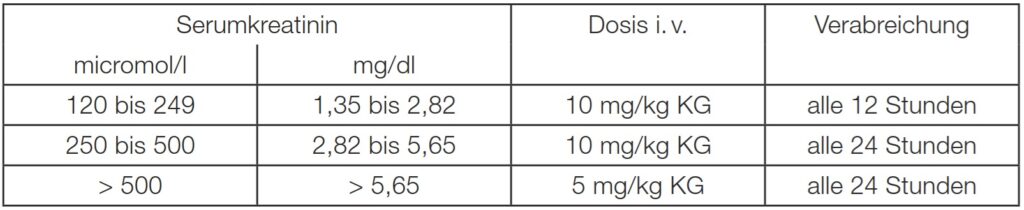
Eingeschränkte Nierenfunktion
Da bei Niereninsuffizienz die Gefahr einer Kumulation besteht, ist die Anwendung von Tranexamsäure bei Patienten mit schwerer Nierenfunktionsstörung kontraindiziert (siehe Abschnitt 4.3). Bei Patienten mit leicht bis mäßig eingeschränkter Nierenfunktion sollte die Dosierung der Tranexamsäure in Abhängigkeit vom Serumkreatininspiegel reduziert werden.
Eingeschränkte Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung nötig.
Kinder und Jugendliche
Für die derzeit zugelassenen, in Abschnitt 4.1 aufgeführten Indikationen liegt die Dosierung für Kinder ab 1 Jahr im Bereich von 20 mg/kg/Tag. Jedoch sind für diese Indikationen nur begrenzt Daten zur Wirksamkeit, Dosierung und Sicherheit verfügbar. Die Wirksamkeit, Dosierung und Sicherheit von Tranexamsäure bei Herzoperationen an Kindern wurden noch nicht umfassend geklärt. Derzeit liegen nur begrenzte Daten vor, die in Abschnitt 5.1 beschrieben werden.
Ältere Patienten
Außer bei Hinweis auf eine eingeschränkte Nierenfunktion ist hier keine Dosisreduktion nötig.
Art der Anwendung
Die Anwendung ist ausschließlich auf eine langsame intravenöse Injektion oder Infusion von maximal 1 ml pro Minute beschränkt (siehe Abschnitt 6.6).
TRANEXAMSÄURE SOLLTE AUS-SCHLIESSLICH INTRAVENÖS VERAB-REICHT WERDEN und darf nicht intra-thekal oder epidural angewendet werden (siehe Abschnitte 4.3 und 4.4).
UM DAS RISIKO TÖDLICHER MEDIKATI-ONSFEHLER AUFGRUND EINER FAL-SCHEN ART DER ANWENDUNG VON TRANEXAMSÄURE ZU VERRINGERN, WIRD DRINGEND EMPFOHLEN, DIE SPRITZEN, DIE TRANEXAMSÄURE ENT-HALTEN, ZU KENNZEICHNEN (siehe Abschnitte 4.3, 4.4 und 6.6).
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Akute venöse oder arterielle Thrombosen (siehe Abschnitt 4.4)
- Hyperfibrinolytische Zustände infolge einer Verbrauchskoagulopathie, außer Fälle, bei denen eine vorherrschende Aktivierung des fibrinolytischen Systems mit akuten schweren Blutungen vorliegt (siehe Abschnitt 4.4)
- Schwere Nierenfunktionsstörung (Kumulationsgefahr)
- Krampfanfälle in der Anamnese
- Intrathekale, epidurale, intraventrikuläre Injektion sowie intrazerebrale Applikation (Gefahr von zerebralen Ödemen und Krampfanfällen sowie Tod)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die oben genannten Indikationen und die Art der Anwendung sind strikt einzuhalten:
- Intravenöse Injektionen oder Infusionen müssen sehr langsam verabreicht werden (max. 1 ml pro Minute).
- Tranexamsäure darf nicht intramuskulär angewendet werden.
Risiko von Medikationsfehlern aufgrund einer falschen Art der Anwendung Cyklokapron-Injektionslösung ist nur zur intravenösen Anwendung bestimmt. Die intrathekale, epidurale, intraventrikuläre und intrazerebrale Anwendung von Cyklokapron-Injektionslösung ist kontraindiziert (siehe Abschnitt 4.3). Es wurde über schwerwiegende unerwünschte Wirkungen, einschließlich tödlicher Ereignisse, berichtet, wenn Tranexamsäure versehentlich intrathekal verabreicht wurde. Zu diesen Ereignissen gehörten schwere Rücken- und Glutealschmerzen, Schmerzen in den unteren Gliedmaßen, Myoklonien und generalisierte Krampfanfälle sowie Herzrhythmusstörungen.
Es sollte sehr sorgfältig darauf geachtet werden, dass Cyklokapron-Injektionslösung korrekt angewendet wird. Medizinisches Fachpersonal sollte sich der Verwechslungsgefahr von Cyklokapron-Injektionslösung mit anderen zur Injektion bestimmten Arzneimitteln bewusst sein, die zu einer versehentlichen intrathekalen Verabreichung von Cyklokapron-Injektionslösung führen könnte. Dazu gehören insbesondere intrathekal injizierte Arzneimittel, die während desselben Verfahrens wie Tra-nexamsäure verwendet werden könnten.
Spritzen, die Cyklokapron-Injektionslösung enthalten, sollten deutlich mit dem Hinweis auf eine intravenöse Verabreichung gekennzeichnet sein.
Krampfanfälle
Im Zusammenhang mit einer Tranexamsäuretherapie ist über Krampfanfälle berichtet worden. In der Koronararterien-Bypass Chirurgie (CABG) wurden die meisten dieser Fälle nach einer intravenösen (i. v.) Injektion von Tranexamsäure in hohen Dosen berichtet. Bei der Anwendung der empfohlenen niedrigeren Dosen von Tranexamsäure traten postoperative Krampfanfälle genauso häufig wie bei unbehandelten Patienten auf.
Sehstörungen
Es sollte auf das mögliche Auftreten von Sehstörungen geachtet werden, einschließlich eingeschränktes Sehvermögen, verschwommenes Sehen, Störungen des Farbensehens und falls erforderlich sollte die Therapie abgebrochen werden. Bei kontinuierlicher Langzeitanwendung von Tranexamsäure sind regelmäßige augenärztliche Kontrollen (Augenuntersuchungen einschließlich Sehschärfe, Farbensehen, Augenhintergrund, Gesichtsfeld etc.) indiziert. Bei pathologischen Augenveränderungen, insbesondere bei Erkrankungen der Netzhaut, muss der behandelnde Arzt die Entscheidung über die Notwendigkeit einer Langzeitanwendung von Tranexamsäure nach Hinzuziehen eines Spezialisten in jedem Einzelfall fällen.
Hämaturie
Bei einer Hämaturie aus dem oberen Harntrakt besteht die Gefahr einer Harnwegsobstruktion in den unteren Ebenen des Trakts.
Unbehandelt kann eine Harnwegsobstruktion zu schwerwiegenden Folgen wie Niereninsuffizienz, Harnwegsinfektion, Hydronephrose und Anurie führen. Daher wird eine engmaschige Überwachung für Patienten mit Hämaturie oder Risiko einer Hämaturie aus den oberen Harnwegen empfohlen.
Thromboembolische Ereignisse
Vor der Anwendung von Tranexamsäure sollte der Patient auf Risikofaktoren thromboembolischer Erkrankungen untersucht werden. Bei Patienten, die thromboembolische Erkrankungen in der Anamnese aufweisen oder bei denen familienanamnes-tisch eine auffällige Häufung an thromboembolischen Ereignissen ermittelt wird (thrombophile Hochrisikopatienten), darf Tranexamsäure nur bei strenger Indikationsstellung nach Rücksprache mit einem hämostaseologisch erfahrenen Arzt und unter engmaschiger medizinischer Überwachung angewendet werden (siehe Abschnitt 4.3). Tranexamsäure sollte bei Patientinnen, die hormonelle Kontrazeption verwenden, aufgrund des erhöhten Thromboserisikos mit Vorsicht angewendet werden (siehe Abschnitt 4.5).
Disseminierte intravasale Koagulopathie
Patienten mit disseminierter intravasaler Ko-agulopathie (DIC) sollten üblicherweise nicht mit Tranexamsäure behandelt werden (siehe Abschnitt 4.3). Wenn Tranexamsäure dennoch angewendet wird, dann nur bei solchen Patienten, bei denen eine Aktivierung des fibrinolytischen Systems überwiegt und akute schwere Blutungen vorliegen.
Charakteristischerweise ergibt sich folgendes hämatologisches Profil: verkürzte Euglobulin-Lyse-Zeit; verlängerte Prothrombinzeit; verringerte Plasmaspiegel von Fibrinogen, Faktor V und VIII, Plasminogen, Fibrinolysin und Alpha-2-Makroglobulin; normale Plasmaspiegel von P und P-Komplex, d. h. von Faktor II (Prothrombin), VIII und X; erhöhte Plasmaspiegel von Fibrinogen-Abbauprodukten; normale Thrombozytenzahl. Hierbei wird davon ausgegangen, dass die zugrunde liegende Erkrankung selbst die verschiedenen Komponenten dieses Profils nicht beeinflusst. In diesen akuten Fällen reicht eine Einzeldosis von 1 g Tranexam-säure oft aus, um die Blutung zu kontrollieren. Bei disseminierter intravasaler Koagu-lopathie sollte die Gabe von Tranexamsäure nur dann erwogen werden, wenn geeignete hämatologische Laborkapazitäten und Kenntnisse vorliegen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Eine gleichzeitige Behandlung mit Antikoagulanzien darf nur unter der engmaschigen Überwachung eines in diesem Bereich erfahrenen Arztes erfolgen. Arzneimittel, die die Hämostase beeinflussen, sollten bei Patienten, die mit Tranexamsäure behandelt werden, nur mit Vorsicht angewendet werden. Es besteht ein erhöhtes Risiko für eine Thrombusbildung während gleichzeitiger Anwendung mit hormoneller Kontrazeption. Alternativ kann die antifibrinolytische Wirkung dieses Arzneimittels durch thrombolytische Arzneimittel antagonisiert werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung eine zuverlässige Verhütungsmethode anwenden (siehe Abschnitte 4.4 und 4.5).
Schwangerschaft
Verfügbare Daten aus veröffentlichten Studien, Fallserien und Fallberichten über die Anwendung von Tranexamsäure bei schwangeren Frauen im 2. und 3. Schwangerschaftstrimenon und zum Zeitpunkt der Entbindung geben keinen Aufschluss darü-ber, ob ein arzneimittelassoziiertes Risiko für Fehlgeburten oder einen ungünstigen Verlauf bei Mutter oder Fötus besteht. Es sind Fälle von Strukturanomalien des Fötus bekannt, die nach der Verabreichung von Tranexamsäure an die Mutter während der Empfängnis oder im 1. Schwangerschaftstrimenon zum Tod des Neugeborenen führten. Aufgrund anderer Störfaktoren ist das Risiko schwerer Geburtsfehler bei der Anwendung von Tranexamsäure während der Schwangerschaft jedoch nicht geklärt.
Tierexperimentelle Studien lassen auf keine unmittelbaren oder mittelbaren schädigenden Wirkungen in Bezug auf die Reproduk-tionstoxizität schließen (siehe Abschnitt 5.3).
Tranexamsäure passiert die Plazenta. Die Konzentration im Nabelschnurblut nach einer intravenösen Injektion von 10 mg/kg bei schwangeren Frauen ist mit etwa 30 mg/l genauso hoch wie im mütterlichen Blut.
In 13 klinischen Studien wurden fötale und/ oder neonatale Funktionsstörungen wie niedriger Apgar-Score, neonatale Sepsis oder Kephalhämatom beschrieben, und in 9 klinischen Studien wurden Veränderungen des Wachstums diskutiert, einschließlich niedrigem Geburtsgewichts und Frühgeburt in der 22 bis 36 Schwangerschaftswoche bei Föten und Säuglingen, die in utero Tranexamsäure ausgesetzt waren.
Bei Entscheidungen über die Anwendung von Tranexamsäure während der Schwangerschaft sollte immer das potenzielle Risiko der Verabreichung von Tranexamsäure für den Fötus im Vergleich zur klinischen Notwendigkeit der Verwendung von Tranexamsäure für die Mutter berücksichtigt werden. Eine exakte Nutzen-Risiko-Bewertung sollte die Entscheidung des behandelnden Arztes bestimmen.
Stillzeit
In der veröffentlichten Literatur wird über das Vorhandensein von Tranexamsäure in der Muttermilch berichtet. Es liegen begrenzte Daten über die Auswirkungen von Tranexamsäure auf das gestillte Kind oder auf die Milchproduktion vor. Die entwicklungs- und gesundheitsfördernde Wirkung des Stillens sollte zusammen mit dem klinischen Bedarf der Mutter an einer Behandlung mit Tranexamsäure und möglichen nachteiligen Auswirkungen der Tra-nexamsäure oder der mütterlichen Grund-erkrankung auf das gestillte Kind berücksichtigt werden. Aufgrund der begrenzten Datenlage kann die Anwendung von Tranexamsäure während der Stillzeit nicht abschließend beurteilt werden.
Fertilität
Es liegen keine klinischen Daten zum Einfluss von Tranexamsäure auf die Fruchtbarkeit vor. In tierexperimentellen Studien hatte Tranexamsäure in klinisch relevanter Dosierung keine Auswirkungen auf die männliche oder weibliche Fertilität (sieh Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurden keine Studien durchgeführt.
4.8 Nebenwirkungen
Die Nebenwirkungen, die aus klinischen Studien und aus den Erfahrungen nach der Markteinführung berichtet wurden, sind nachfolgend nach Organklassen geordnet aufgeführt.
Tabellarische Auflistung der Nebenwirkungen
Die berichteten Nebenwirkungen sind in der Tabelle auf Seite 3 zusammengefasst. Sie sind nach MedDRA-Systemorganklassen geordnet. Innerhalb jeder Systemorganklasse sind die Nebenwirkungen nach deren Häufigkeit aufgeführt. Innerhalb jeder Häufigkeitsklasse sind die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Meldung des Verdachts auf Nebenwirkungen

Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, KurtGeorg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet. Als Anzeichen und Symptome können u. a. Schwindel, Kopfschmerzen, Hypotonie und Krampfanfälle auftreten. Es hat sich gezeigt, dass Krampfanfälle bei höheren Dosen tendenziell häufiger auftreten. Eine Überdosierung sollte symptomatisch behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika, Antifibrinolytika, Aminosäuren; ATC-Code: B02AA02
Tranexamsäure zeigt eine antihämorrhagische Wirkung, indem es die fibrinolytischen Eigenschaften von Plasmin hemmt.
Es bildet sich ein Komplex aus Tranexam-säure und Plasminogen; Tranexamsäure bindet an Plasminogen und hemmt dessen Aktivierung zu Plasmin.
Die Aktivität des Tranexamsäure-Plasmin-Komplexes auf die Aktivität von Fibrin ist geringer als die Aktivität von freiem Plasmin alleine.
In-vitro-Studien haben gezeigt, dass hohe Dosierungen von Tranexamsäure die Aktivität von Komplement vermindern.
Kinder und Jugendliche
Bei Kindern im Alter > 1 Jahr
In einer Literaturübersicht fanden sich 12 Studien zur Wirksamkeit bei Herzoperationen im Kindesalter mit insgesamt 1 073 Kindern, von denen 631 Kinder Tra-nexamsäure erhalten haben. Bei den meisten Studien handelte es sich um kontrollierte Studien gegen Placebo. Die untersuchte Population war heterogen im Hinblick auf Alter, Art der Operationen und Dosierungsschemata. Die Studienergebnisse mit Tra-nexamsäure weisen auf einen verminderten Blutverlust und einen verminderten Bedarf an Blutprodukten bei kardiopulmonalen By-pass Operationen im Kindesalter hin, wenn ein hohes Blutungsrisiko besteht, insbesondere bei zyanotischen Patienten oder Patienten, die wiederholt operiert werden. Das bestangepasste Dosierungsschema scheint Folgendes zu sein:
- zunächst Bolus von 10 mg/kg nach Einleiten der Anästhesie und vor dem Einschnitt in die Haut,
- Dauerinfusion von 10 mg/kg/Stunde oder Injektion in das Priming der Herz-LungenMaschine in einer Dosierung, die an das Verfahren des kardiopulmonalen Bypass angepasst ist, entweder entsprechend des Gewichts des Patienten mit einer Dosis von 10 mg/kg oder entsprechend des Priming-Volumens der Herz-LungenMaschine, wobei die letzte Injektion von 10 mg/kg am Ende des kardiopulmonalen Bypass appliziert werden soll.
Begrenzte Daten bei nur sehr wenigen Patienten deuten darauf hin, dass eine Dauer-infusion vorzuziehen ist, da sich so therapeutische Plasmakonzentrationen während des gesamten Eingriffs aufrechterhalten lassen. Zur Dosis-Wirkungsbeziehung oder Pharmakokinetik bei Kindern wurden keine speziellen Studien durchgeführt.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach einer kurzen intravenösen Infusion werden schnell die maximalen Plasmakonzentrationen von Tranexamsäure erreicht. Anschließend verringern sich die Plasmakonzentrationen wieder in einem multiexponenziellen Verlauf.
Verteilung
Bei therapeutischen Plasmaspiegeln beträgt die Plasmaeiweißbindung von Tranexamsäure ca. 3 % und scheint vollständig auf die Bindung an Plasminogen zurückzuführen zu sein. Tranexamsäure bindet nicht an Serumalbumin. Das initiale Verteilungsvolumen beträgt 9 bis 12 Liter. Tranexamsäure ist plazentagängig. Nach einer intravenösen Injektion von 10 mg/kg bei 12 schwangeren Frauen bewegte sich die Serumkonzentration von Tranexamsäure zwischen 10 und 53 μg/ml und die Konzentration im Nabelschnurblut zwischen 4 und 31 μg/ml. Tranexamsäure diffundiert rasch in die Gelenkflüssigkeit und die Synovialmembran. Nach einer intravenösen Injektion von 10 mg/kg bei 17 Patienten mit Knieoperationen waren die Konzentrationen in der Gelenkflüssigkeit vergleichbar mit denen in den entsprechenden Blutproben. Die Konzentrationen von Tranexamsäure in einer Vielzahl anderer Gewebe beträgt nur einen Bruchteil der Konzentration im Blut (Muttermilch 1/100; Zerebrospinalflüssigkeit 1/10, Kammerwasser 1/10). Tranexamsäure wurde im Sperma nachgewiesen, wo sie die fibrinolytische Aktivität hemmt, die Migration der Spermien jedoch nicht beeinflusst.
Elimination
Es wird hauptsächlich mit dem Urin in unveränderter Form ausgeschieden. Die renale Ausscheidung durch glomeruläre Filtration stellt den hauptsächlichen Eliminati-onsweg dar. Die renale Clearance entspricht der Plasma-Clearance (110 bis 116 ml/min). Nach intravenöser Gabe von 10 mg/kg KG werden rund 90 % der Tranexamsäure innerhalb der ersten 24 Stunden wieder ausgeschieden. Die Eliminationshalbwertszeit von Tranexamsäure beträgt etwa 3 Stunden.
Andere besondere Patientenpopulationen
Bei Patienten mit Nierenversagen erhöhen sich die Plasmakonzentrationen.
Bei Kindern wurden keine spezifischen Pharmakokinetikstudien durchgeführt.
5.3 Präklinische Daten zur Sicherheit
Karzinogenese und Mutagenese
In konventionellen Studien mit Tranexam-säure wurden keine Hinweise auf Karzino-genität oder Mutagenität festgestellt.
Reproduktionstoxizität
In Studien zur Reproduktionstoxizität (Studien zur Fertilität und frühen Embryonalentwicklung, Studien zur embryofötalen Entwicklung sowie prä- und postnatale Studien) hatte Tranexamsäure bei Mäusen, Ratten und Kaninchen in klinisch relevanten Dosen keine nachteiligen Auswirkungen auf die Reproduktionsparameter.
Allgemeine Toxikologie
In nichtklinischen Studien mit Tranexam-säure wurde Netzhauttoxizität beobachtet. Die beobachtete Toxizität war durch eine Atrophie der Netzhaut gekennzeichnet, die mit Veränderungen des retinalen Pigment-epithels begann und bei Katzen bis zur Netzhautablösung fortschritt. Die Toxizität schien dosisabhängig zu sein, und die Veränderungen waren bei niedrigeren Dosen teilweise reversibel. Bei Katzen wurden Wirkungen (einige davon vollständig reversibel) bei klinisch relevanten Dosen beobachtet, bei Hunden wurden Wirkungen erst bei einem Vielfachen der klinischen Dosis beobachtet. Studien deuten darauf hin, dass der zugrundeliegende Mechanismus mit einer vorübergehenden retinalen Ischämie bei höheren Dosen in Verbindung mit der bekannten sympathomimetischen Wirkung hoher Plasmaspiegel von Tranexam-säure zusammenhängen könnte. Die klinische Relevanz dieser Befunde ist nicht bekannt. Im Tierversuch wurde bei intrathekaler Anwendung von Tranexamsäure eine epi-leptogene Wirkung festgestellt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit Blutkonserven oder penicillinhaltigen Injektionslösungen gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre
Nach Anbruch: Die Injektions-/ Infusionslösung ist zur einmaligen Anwendung bestimmt, nicht verbrauchte Lösung ist zu verwerfen.
Chemische und physikalische Anbruchsta-bilität wurde für 24 Stunden bei 25 °C nachgewiesen.
Aus mikrobiologischer Sicht muss das Arzneimittel sofort verbraucht werden. Wenn es nach Anbruch nicht sofort verbraucht wird, liegen Aufbewahrungszeit und -bedingun-gen vor der Anwendung in der Verantwortung des Anwenders.
6.4 Besondere Vorsichtsmaßnahmenfür die Aufbewahrung
Nicht einfrieren.
Zu Lagerungsbedingungen nach erstem Anbruch des Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Packungen mit 5, 6 oder 10 Typ-I-Glas-5-ml-Ampullen im Umkarton N 2 ; jede Ampulle enthält 500 mg Tranexamsäure.
Packungen mit 10 Typ-I-Glas-10-ml-Ampullen im Umkarton; jede Ampulle enthält 1 000 mg Tranexamsäure.
Packungen mit 10 × 1 Typ-I-Glas-5-ml-Ampulle im Umkarton; jede Ampulle enthält 500 mg Tranexamsäure.
Packungen mit 10 × 1 Typ-I-Glas-10-ml-Ampulle im Umkarton N 2 ; jede Ampulle enthält 1 000 mg Tranexamsäure.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Medizinischem Fachpersonal wird dringend empfohlen, die Spritzen mit Cyklokapron-Injektionslösung beim Entnehmen des Arzneimittels aus der Ampulle zu kennzeichnen, um eine eindeutige Identifizierung und eine ordnungsgemäße Art der Anwendung zu gewährleisten. Dies dient der Vermeidung unbeabsichtigter Medikationsfehler während der Verabreichung an den Patienten.
Cyklokapron-Injektionslösung kann mit den meisten Infusionslösungen, wie z. B. Elektrolytlösungen, Kohlenhydratlösungen, Aminosäurelösungen und Dextranlösungen, gemischt werden. Der Cyklokapron-Injektionslösung kann Heparin hinzugegeben werden.
Cyklokapron-Injektionslösung ist zur einmaligen Anwendung bestimmt. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
PFIZER PHARMA GmbH Friedrichstr. 110
10117 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
8. ZULASSUNGSNUMMER
6376165.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
19. Dezember 2005
10. STAND DER INFORMATION
April 2024
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig