Augmentin
Anmerkung:
Bei Augementin handelt es sich um verschreibungspflichtiges Arzneimittel. Der Preis pro Packung (875/125MG – 10 Stück) liegt bei ca. 11 Euro bis 12 Euro.
1. Bezeichnung des Arzneimittels
Augmentin 875 mg/125 mg Filmtabletten
2. Qualitative und Quantitative Zusammensetzung
Jede Filmtablette enthält Amoxicillin-Trihydrat entsprechend 875 mg Amoxicillin und Kaliumclavulanat entsprechend 125 mg Clavulansäure. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Filmtabletten
Weiße bis cremefarbene kapselförmige Tablette mit der Gravur „AC“ auf beiden Seiten und einer Bruchkerbe auf einer Seite. Die Bruchkerbe dient nur zum Teilen der Tablette, um das Schlucken zu erleichtern, und nicht zum Teilen in gleiche Dosen
4. Klinische Angaben
4.1 Anwendungsgebiete
Augmentin ist für die Behandlung folgender Infektionen bei Erwachsenen und Kindern indiziert (siehe Abschnitte 4.2, 4.4 und 5.1):
- akute bakterielle Sinusitis (nach adäquater Diagnosestellung)
- akute Otitis media
- akute Exazerbationen einer chronischen Bronchitis (nach adäquater Diagnosestellung)
- ambulant erworbene Pneumonie
- Zystitis
- Pyelonephritis
- Haut- und Weichteilinfektionen, insbesondere Infektionen der unteren Hautschichten, Tierbisse, schwere dentale Abszesse mit sich lokal ausbreitender Infektion.
- Knochen- und Gelenkinfektionen, insbesondere Osteomyelitis.
Die offiziellen Richtlinien für den angemessenen Gebrauch von Antibiotika sind zu beachten.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosen werden jeweils als Gehalt an Amoxicillin/Clavulansäure angegeben, sofern nicht die Dosis eines Einzelbestandteils genannt wird. Die Dosis von Augmentin, die zur Behandlung einer bestimmten Infektion ausgewählt wird, sollte folgendes berücksichtigen:
- die erwarteten Erreger und deren voraussichtliche Empfindlichkeit gegenüber antibakteriellen Wirkstoffen (siehe Abschnitt 4.4)
- die Schwere und den Ort der Infektion
- das Alter, Gewicht und die Nierenfunktion des Patienten wie unten dargestellt.
Der Gebrauch von alternativen Augmentin-Formulierungen (z. B. solchen, die höhere Dosen von Amoxicillin und/oder unterschiedliche Verhältnisse von Amoxicillin zu Clavulansäure bieten) sollte gegebenenfalls berücksichtigt werden (siehe Abschnitte 4.4 und 5.1).
Für Erwachsene und Kinder ≥ 40 kg enthält diese Augmentin-Formulierung bei einer Anwendung wie unten beschrieben eine tägliche Gesamtdosis von 1750 mg Amoxicillin/250 mg Clavulansäure bei zweimal täglicher Gabe und 2.625 mg Amoxicillin/375 mg Clavulansäure bei dreimal täglicher Gabe. Für Kinder < 40 kg enthält diese Augmentin-Formulierung bei einer Anwendung wie unten beschrieben eine maximale tägliche Dosis von 1.000-2.800 mg Amoxicillin/143-400 mg Clavulansäure. Wenn eine höhere tägliche Dosis von Amoxicillin nötig ist, wird empfohlen, eine andere Augmentin-Formulierung auszuwählen, um die Gabe unnötig hoher täglicher Dosen von Clavulansäure zu vermeiden (siehe Abschnitte 4.4 und 5.1).
Die Dauer der Behandlung sollte durch das Ansprechen des Patienten bestimmt werden. Einige Infektionen (z.B. Osteomyelitis) benötigen eine längere Behandlungsdauer. Die Behandlung sollte ohne Überprüfung 14 Tage nicht überschreiten (siehe Abschnitt 4.4 bezüglich einer längerfristigen Behandlung).
Erwachsene und Kinder ≥ 40 kg
Empfohlene Dosen:
- Standarddosis (bei allen Indikationen): zweimal täglich 875 mg/125 mg;
- Erhöhte Dosis (insbesondere bei Infektionen wie Otitis media, Sinusitis, Infektionen der unteren Atemwege und Harnwegsinfektionen): dreimal täglich 875 mg/125 mg.
Kinder < 40 kg
Kinder können mit Augmentin Tabletten oder Suspensionen behandelt werden.
Empfohlene Dosen:
- 25 mg/3,6 mg/kg/Tag bis 45 mg/6,4 mg/kg/Tag aufgeteilt in zwei Tagesdosen;
- bis zu 70 mg/10 mg/kg/Tag aufgeteilt in zwei Tagesdosen können bei einigen Infektionen wie Otitis media, Sinusitis und Infektionen der unteren Atemwege in Erwägung gezogen werden.
Da die Tabletten nicht aufgeteilt werden können, dürfen Kinder unter 25 kg Körpergewicht nicht mit Augmentin Tabletten behandelt werden.
Die untenstehende Tabelle zeigt die erhaltene Dosis (mg/kg/KG) bei Kindern zwischen 25 kg und 40 kg nach Verabreichung einer einzelnen 875 mg/125 mg Tablette.
| Körpergewicht [kg] | 40 | 35 | 30 | 25 | Empfohlene Einzeldosis [mg/kg/
KG] (siehe oben) |
| Amoxicillin [mg/kg/KG] pro Einzeldosis (1 Filmtablette) | 21,9 | 25,0 | 29,2 | 35,0 | 12,5 – 22,5 (bis zu 35) |
| Clavulansäure [mg/kg/KG] pro Einzeldosis (1 Filmtablette) | 3,1 | 3,6 | 4,2 | 5,0 | 1,8 – 3,2 (bis zu 5) |
Kinder unter 25 kg sollten vorzugsweise mit Augmentin Suspensionen behandelt werden.
Es sind keine klinischen Daten zu Augmentin-7:1-Formulierungen in Dosen von mehr als 45 mg/6,4 mg je kg pro Tag bei Kindern unter 2 Jahren verfügbar.
Es sind keine klinischen Daten zu Augmentin-7:1-Formulierungen bei Patienten unter 2 Monaten verfügbar. Daher können für diese Altersgruppe keine Dosierungsempfehlungen gegeben werden.
Ältere Patienten
Eine Dosisanpassung wird als nicht erforderlich betrachtet.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit einer Kreatinin-Clearance (KrCl) von mehr als 30 ml/min ist keine Dosisanpassung erforderlich.
Bei Patienten mit einer Kreatinin-Clearance von unter 30 ml/min wird die Anwendung von Augmentin-Präparaten mit einem Verhältnis von Amoxicillin zu Clavulansäure von 7:1 nicht empfohlen, da keine Empfehlungen für eine Dosisanpassung verfügbar sind.
Patienten mit eingeschränkter Leberfunktion
Mit Vorsicht dosieren und die Leberfunktion regelmäßig kontrollieren (siehe Abschnitte 4.3 und 4.4).
Art der Anwendung
Augmentin ist zum Einnehmen bestimmt.
Die Einnahme von Augmentin soll zur Minimierung einer möglichen gastrointestinalen Unverträglichkeit mit einer Mahlzeit erfolgen.
Die Behandlung kann gemäß der Zusammenfassung der Merkmale des Arzneimittels der intravenösen Formulierung parenteral eingeleitet und mit einer oralen Formulierung fortgesetzt werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe, gegen Penicilline oder einen der sonstigen Bestandteile, siehe Abschnitt 6.1.
Schwere allergische Sofortreaktion (z. B. Anaphylaxie) gegen ein anderes Betalaktam-Antibiotikum (z. B. einem Cephalosporin, Carbapenem oder Monobactam) in der Krankheitsgeschichte.
Gelbsucht/Leberfunktionsstörung in der Krankheitsgeschichte, die durch Amoxicillin/Clavulansäure hervorgerufen wurde (siehe Abschnitt 4.8).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vor Beginn einer Behandlung mit Amoxicillin/Clavulansäure ist der Patient sorgfältig nach früheren Überempfindlichkeitsreaktionen auf Penicilline, Cephalosporine oder andere Betalaktam-Antibiotika zu befragen (siehe Abschnitte 4.3 und 4.8).
Bei Patienten, die mit Penicillinen behandelt wurden, wurden schwerwiegende und gelegentlich
tödlich verlaufende Überempfindlichkeitsreaktionen (einschließlich anaphylaktoider und schwerer kutaner Reaktionen) beschrieben. Überempfindlichkeitsreaktionen können auch zum Kounis-Syndrom führen, einer schweren allergischen Reaktion, die einen Myokardinfarkt zur Folge haben kann (siehe Abschnitt 4.8). Personen mit einer Überempfindlichkeitsreaktion gegen Penicilline in der
Vorgeschichte und atopische Personen tragen ein erhöhtes Risiko für solche Reaktionen. Das arzneimittelbedingte Enterokolitissyndrom (DIES) wurde hauptsächlich bei Kindern berichtet, die Amoxicillin/Clavulansäure erhalten haben (siehe Abschnitt 4.8). DIES ist eine allergische Reaktion
mit dem Leitsymptom anhaltenden Erbrechens (1-4 Stunden nach der Einnahme des Arzneimittels) bei einem Fehlen von allergischen Haut- oder Atemwegssymptomen. Weitere Symptome können Bauchschmerzen, Diarrhö, Hypotonie oder Leukozytose mit Neutrophilie sein. Es sind schwere Fälle inklusive einer Progression bis hin zum Schock aufgetreten. Sollte es zu einer allergischen Reaktion kommen, muss die Therapie mit Amoxicillin/Clavulansäure beendet und eine geeignete Alternativ- Therapie begonnen werden.
In Fällen, in denen eine Infektion nachweislich durch Amoxicillin-empfindliche Erreger verursacht wird, sollte in Übereinstimmung mit den offiziellen Richtlinien ein Wechsel von einer Behandlung mit Amoxicillin/Clavulansäure zu einer Therapie mit Amoxicillin in Ewägung gezogen werden.
Diese Augmentin-Formulierung ist nicht für den Gebrauch geeignet, wenn ein hohes Risiko besteht, dass die vermuteten Erreger eine Resistenz gegenüber Betalaktam-Antibiotika aufweisen, die nicht durch Betalaktamasen hervorgerufen wird. Dieses Präparat sollte nicht zur Behandlung von Penicillin- resistenten S. pneumoniae verwendet werden.
Bei Patienten mit eingeschränkter Nierenfunktion oder bei Patienten, die hohe Dosen erhalten, können Krampfanfälle auftreten (siehe Abschnitt 4.8).
Amoxicillin/Clavulansäure sollte bei Verdacht auf eine infektiöse Mononukleose vermieden werden, da es bei der Anwendung von Amoxicillin bei dieser Erkrankung zu einem masernartigen Hautausschlag kommen kann.
Die gleichzeitige Anwendung von Allopurinol während einer Behandlung mit Amoxicillin kann die Wahrscheinlichkeit für allergische Hautreaktionen erhöhen.
Bei längerfristiger Anwendung kann es gelegentlich zu einem übermäßigen Wachstum von unempfindlichen Erregern kommen.
Das Auftreten eines fieberhaften, generalisierten Erythems, das mit Pustelbildung verbunden ist, zu Beginn der Behandlung kann ein Symptom eines akuten generalisierten pustulösen Exanthems
(AGEP) sein (siehe Abschnitt 4.8). Diese Reaktion erfordert ein Absetzen von Augmentin und ist eine Gegenanzeige für jegliche darauffolgende Gabe von Amoxicillin.
Amoxicillin/Clavulansäure sollte bei Patienten, bei denen nachweislich eine Einschränkung der Leberfunktion vorliegt, mit Vorsicht angewendet werden (siehe Abschnitte 4.2, 4.3 und 4.8).
Hepatische Ereignisse wurden vorwiegend bei männlichen Patienten und bei älteren Patienten beschrieben und können mit einer längerfristigen Behandlung einhergehen. Derartige Ereignisse wurden bei Kindern sehr selten beschrieben. In allen Populationen treten die Anzeichen und Symptome in der Regel während oder kurz nach der Behandlung auf, in einigen Fällen aber auch erst mehrere Wochen nach Behandlungsende. In der Regel sind diese Ereignisse reversibel. Hepatische Ereignisse können schwerwiegend sein, in sehr seltenen Fällen wurde über Todesfälle berichtet. Diese betrafen fast immer Patienten mit schwerwiegender Grunderkrankung oder solche, die gleichzeitig Arzneimittel einnahmen, von denen bekannt ist, dass sie hepatische Nebenwirkungen verursachen können (siehe Abschnitt 4.8).
Bei fast allen Antibiotika einschließlich Amoxicillin wurde über Fälle von Antibiotika-assoziierter Kolitis berichtet, deren Schweregrad leicht bis lebensbedrohlich sein kann (siehe Abschnitt 4.8).
Daher ist es wichtig, bei Patienten, bei denen es während oder nach Anwendung eines Antibiotikums zu Durchfall kommt, an diese Diagnose zu denken. Sollte eine Antibiotika-assoziierte Kolitis auftreten, muss Amoxicillin/Clavulansäure sofort abgesetzt, ein Arzt aufgesucht und eine angemessene Behandlung begonnen werden. Arzneimittel, die die Peristaltik hemmen, sind in diesem Fall kontraindiziert.
Während einer längerfristigen Behandlung sollten die Organfunktionen, einschließlich Nieren-, Leber- und hämatopoetische Funktion, regelmäßig kontrolliert werden.
Bei mit Amoxicillin/Clavulansäure behandelten Patienten wurde in seltenen Fällen über eine Verlängerung der Prothrombinzeit berichtet. Bei gleichzeitiger Verordnung von Antikoagulantien sind angemessene Kontrollen durchzuführen. Möglicherweise muss die Dosis von oralen Antikoagulantien angepasst werden, um den gewünschten Grad an Antikoagulation zu erzielen (siehe Abschnitte 4.5 und 4.8).
Bei Patienten mit eingeschränkter Nierenfunktion sollte die Dosis dem Schweregrad der Nierenfunktionsstörung angepasst werden (siehe Abschnitt 4.2).
Bei Patienten mit verminderter Harnausscheidung wurde in sehr seltenen Fällen eine Kristallurie (einschließlich akuter Nierenschädigung) beobachtet, und zwar vorwiegend unter einer parenteralen Therapie. Während der Anwendung hoher Amoxicillin-Dosen ist auf eine adäquate Flüssigkeitszufuhr und Harnausscheidung zu achten, um das Risiko für eine Amoxicillin-Kristallurie zu verringern. Bei Patienten mit Blasenkatheter ist die Durchgängigkeit des Katheters regelmäßig zu kontrollieren (siehe Abschnitte 4.8 und 4.9).
Während der Behandlung mit Amoxicillin sollten bei der Glucose-Bestimmung im Urin stets enzymatische Methoden auf der Basis von Glucoseoxidasen verwendet werden, da nicht-enzymatische Methoden falsch-positive Ergebnisse ergeben können.
Die in Augmentin enthaltene Clavulansäure kann eine unspezifische Bindung von IgG und Albumin an die Erythrozytenmembran verursachen, was ein falsch-positives Ergebnis im Coombs-Test zur Folge haben kann.
Es gab Berichte über positive Versuchsergebnisse bei Verwendung des Bio-Rad Laboratories Platelia Aspergillus EIA-Tests bei Patienten, die Amoxicillin/Clavulansäure erhalten haben und bei denen anschließend festgestellt wurde, dass sie keine Aspergillus-Infektion hatten. Von Kreuzreaktionen mit Polysacchariden und Polyfuranosen von nicht-Aspergillus-Spezies unter Verwendung des Bio-Rad Laboratories Platelia Aspergillus EIA-Tests wurde berichtet. Daher sollten positive Ergebnisse bei Patienten, die Amoxicillin/Clavulansäure erhalten, mit Vorsicht interpretiert werden und durch weitere diagnostische Methoden bestätigt werden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu „natriumfrei“.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Orale Antikoagulantien
Orale Antikoagulantien und Penicillin-Antibiotika finden breite Anwendung in der Praxis, und es liegen keine Berichte über Wechselwirkungen vor. Allerdings wurden in der Literatur Fälle von erhöhten Werten der International Normalised Ratio (INR) bei Patienten beschrieben, die mit Acenocoumarol oder Warfarin behandelt wurden und denen eine Behandlung mit Amoxicillin verordnet wurde. Wenn eine gemeinsame Anwendung notwendig ist, sollten zu Beginn und am Ende der Behandlung mit Amoxicillin die Prothrombinzeit oder der INR-Wert sorgfältig überwacht werden. Zusätzlich können Dosisanpassungen bei den oralen Antikoagulantien notwendig werden (siehe Abschnitte 4.4 und 4.8).
Methotrexat
Penicilline können die Ausscheidung von Methotrexat verringern und damit eine mögliche Erhöhung der Toxizität verursachen.
Probenecid
Die gleichzeitige Anwendung von Probenecid wird nicht empfohlen. Probenecid vermindert die tubuläre Sekretion von Amoxicillin in der Niere. Die gleichzeitige Anwendung von Probenecid kann erhöhte und länger anhaltende Blutspiegel von Amoxicillin, aber nicht von Clavulansäure, zur Folge haben.
Mycophenolat-Mofetil
Bei Patienten, die Mycophenolat-Mofetil erhalten, wurde eine Reduktion der Pre-Dosis Konzentration des aktiven Metaboliten Mycophenolsäure (MPA) von ungefähr 50% berichtet, nachdem mit der Behandlung mit oralem Amoxicillin und Clavulansäure begonnen wurde. Es kann sein, dass die Veränderung der Pre-Dosis Höhe nicht genau die Änderungen der gesamt MPA Exposition darstellt. Daher sollte, ohne klinischen Nachweis einer Transplantat Fehlfunktion, eine Änderung der Mycophenolat-Mofetil Dosierung normalerweise nicht notwendig sein. Dennoch sollte eine engmaschige klinische Überwachung während der Kombination und kurz nach Antibiotika Behandlung durchgeführt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung schließen
(siehe Abschnitt 5.3). Begrenzte Daten beim Menschen zur Verwendung von Amoxicillin/Clavulansäure während der Schwangerschaft weisen nicht auf ein erhöhtes Risiko von Geburtsfehlern hin. In einer einzigen Studie an Frauen mit vorzeitigem Blasensprung wurde beschrieben, dass die prophylaktische Anwendung von Amoxicillin-Clavulansäure mit einem erhöhten Risiko für eine nekrotisierende Enterokolitis bei Neugeborenen einherging. Die Anwendung während der Schwangerschaft sollte vermieden werden, es sei denn, der behandelnde Arzt hält sie für unverzichtbar.
Stillzeit
Beide Substanzen gehen in die Muttermilch über (es ist nichts über die Auswirkungen von Clavulansäure auf den gestillten Säugling bekannt). Folglich sind Durchfall und eine Pilzinfektion der Schleimhäute beim gestillten Säugling möglich, so dass eventuell abgestillt werden muss. Die Möglichkeit einer Sensibilisierung ist zu berücksichtigen. Amoxicillin/Clavulansäure sollte während der Stillzeit nur nach einer Nutzen/Risiko-Abwägung durch den behandelnden Arzt verabreicht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Allerdings kann es zu Nebenwirkungen (z. B. allergischen Reaktionen, Schwindel, Krampfanfällen) kommen, die die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen können (siehe Abschnitt 4.8).
4.8 Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen sind Durchfall, Übelkeit und Erbrechen.
Die Nebenwirkungen von Augmentin aus klinischen Studien und aus Berichten nach Markteinführung sind im Folgenden nach MedDRA-Systemorganklassen sortiert aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
- Sehr häufig (≥1/10)
- Häufig (≥1/100 bis <1/10)
- Gelegentlich (≥1/1.000 bis <1/100)
- Selten (≥1/10.000 bis <1/1.000)
- Sehr selten (<1/10.000)
- Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Infektionen und parasitäre Erkrankungen
| Mukokutane Candidose | Häufig |
| Übermäßiges Wachstum von unempfindlichen Organismen | Nicht bekannt |
Erkrankungen des Blutes und des Lymphsystems
| Reversible Leukopenie (einschließlich Neutropenie) | Selten |
| Thrombozytopenie | Selten |
| Reversible Agranulozytose | Nicht bekannt |
| Hämolytische Anämie | Nicht bekannt |
| Verlängerung der Blutungszeit und der Prothrombinzeit1 | Nicht bekannt |
Erkrankungen des Immunsystems8
| Angioneurotisches Ödem | Nicht bekannt |
| Anaphylaxie | Nicht bekannt |
| Überempfindlichkeit wie bei Serumkrankheit | Nicht bekannt |
| Allergische Vaskulitis | Nicht bekannt |
Erkrankungen des Nervensystems
| Schwindel | Gelegentlich |
| Kopfschmerzen | Gelegentlich |
| Reversible Hyperaktivität | Nicht bekannt |
| Krampfanfälle1 | Nicht bekannt |
| Aseptische Meningitis | Nicht bekannt |
Herzerkrankungen
| Kounis-Syndrom | Nicht bekannt |
Erkrankungen des Gastrointestinaltrakts
| Durchfall | Sehr häufig |
| Übelkeit2 | Häufig |
| Erbrechen | Häufig |
| Magenverstimmung | Gelegentlich |
| Antibiotika-assoziierte Kolitis3 | Nicht bekannt |
| Arzneimittelbedingtes Enterokolitissyndrom | Nicht bekannt |
| Akute Pankreatitis | Nicht bekannt |
| Schwarze Haarzunge | Nicht bekannt |
Leber- und Gallenerkrankungen
| Anstieg von AST und/oder ALT4 | Gelegentlich |
| Hepatitis5 | Nicht bekannt |
| Cholestatischer Ikterus5 | Nicht bekannt |
Erkrankungen der Haut und des Unterhautzellgewebes6
| Erkrankungen der Haut und des Unterhautzellgewebes6 | |
| Hautausschlag | Gelegentlich |
| Pruritus | Gelegentlich |
| Urtikaria | Gelegentlich |
| Erythema multiforme | Selten |
| Stevens-Johnson-Syndrom | Nicht bekannt |
| Toxische epidermale Nekrolyse | Nicht bekannt |
| Bullöse exfoliative Dermatitis | Nicht bekannt |
| Akutes generalisiertes pustulöses Exanthem (AGEP)1 | Nicht bekannt |
| Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) | Nicht bekannt |
| Symmetrisches arzneimittelbedingtes intertriginöses und flexurales Exanthem (SDRIFE) (Pavian-Syndrom) | Nicht bekannt |
| Lineare IgA-Erkrankung | Nicht bekannt |
| Erkrankungen der Nieren und Harnwege | Nicht bekannt |
| Interstitielle Nephritis | Nicht bekannt |
| Kristallurie (einschließlich akuter Nierenschädigung)7 | Nicht bekannt |
1 Siehe Abschnitt 4.4
2 Übelkeit tritt häufiger in Verbindung mit höheren oralen Dosen auf. Das Auftreten von gastrointestinalen Nebenwirkungen kann verringert werden, wenn Amoxicillin/Clavulansäure mit einer Mahlzeit eingenommen wird.
3 Einschließlich pseudomembranöser Kolitis und hämorrhagischer Kolitis (siehe Abschnitt 4.4)
4 Bei Patienten, die mit Betalaktam-Antibiotika behandelt wurden, war ein moderater Anstieg von AST und/oder ALT zu beobachten, dessen Bedeutung allerdings unklar ist.
5 Diese Ereignisse wurden bei anderen Penicillinen und Cephalosporinen beobachtet (siehe Abschnitt 4.4)
6 Wenn eine entzündliche Überempfindlichkeitsreaktion der Haut auftritt, sollte die Behandlung beendet werden (siehe Abschnitt 4.4).
7 Siehe Abschnitt 4.9
8 Siehe Abschnitt 4.3 und 4.4
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen:
Österreich:
Bundesamt für Sicherheit im Gesundheitswesen Traisengasse 5
1200 WIEN
Österreich
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
4.9 Überdosierung
Symptome und Anzeichen einer Überdosierung
Es kann zu gastrointestinalen Symptomen und zu Störungen des Flüssigkeits- und Elektrolythaushalts kommen. Es wurde eine Amoxicillin-Kristallurie beschrieben, die in einigen Fällen zu einer Niereninsuffizienz führte (siehe Abschnitt 4.4).
Bei Patienten mit eingeschränkter Nierenfunktion oder bei Anwendung hoher Dosen kann es zu Krampfanfällen kommen.
Es wurde über eine Ausfällung von Amoxicillin in Blasenkathetern berichtet, und zwar insbesondere nach intravenöser Verabreichung hoher Dosen. Die Durchgängigkeit der Katheter ist regelmäßig zu kontrollieren (siehe Abschnitt 4.4).
Behandlung einer Intoxikation
Gastrointestinale Symptome können unter Beachtung des Flüssigkeits- und Elektrolythaushalts symptomatisch behandelt werden.
Amoxicillin/Clavulansäure lässt sich mittels Hämodialyse aus dem Blut entfernen.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kombinationen von Penicillinen, inkl. Betalaktamase-Inhibitoren; ATC-Code: J01CR02.
Wirkmechanismus
Amoxicillin ist ein halbsynthetisches Penicillin (Betalaktam-Antibiotikum), das eines oder mehrere
der für die Biosynthese des bakteriellen Peptidoglycans notwendigen Enzyme (häufig Penicillin- bindende Proteine genannt, PBP) hemmt, welches ein integraler struktureller Bestandteil der Bakterienzellwand ist. Die Hemmung der Peptidoglycan-Synthese hat eine Schwächung der Zellwand zur Folge, was in der Regel zur Zelllyse und zum Absterben führt.
Amoxicillin kann durch Betalaktamasen, die von resistenten Bakterien gebildet werden, abgebaut werden, so dass das Wirkspektrum von Amoxicillin allein keine Erreger umfasst, die diese Enzyme bilden.
Clavulansäure ist ein Betalaktam, das strukturell mit den Penicillinen verwandt ist. Es inaktiviert einige Betalaktamasen und verhindert dadurch die Inaktivierung von Amoxicillin. Clavulansäure allein übt keine klinisch relevante antibakterielle Wirkung aus.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Zeitdauer des Wirkstoffspiegels oberhalb der minimalen Hemmkonzentration (T>MHK) gilt als wichtigste Kenngröße für die Wirksamkeit von Amoxicillin.
Resistenzmechanismen
Die zwei wichtigsten Resistenzmechanismen gegenüberAmoxicillin/Clavulansäure sind:
- Inaktivierung durch solche bakteriellen Betalaktamasen, die selbst nicht durch Clavulansäure inhibiert werden, einschließlich Klasse B, C und D.
- Veränderung der PBPs, welche die Affinität des antibakteriellen Wirkstoffs zur Zielstruktur reduzieren.
Impermeabilität der Bakterien oder Mechanismen von Effluxpumpen können bakterielle Resistenz, insbesondere bei Gram-negativen Bakterien, verursachen oder fördern.
Empfindlichkeitstest Grenzwerte
Die Interpretationskriterien für die MHK (minimale Hemmkonzentration) für Empfindlichkeitstests wurden vom Europäischen Komitee für antimikrobielle Empfindlichkeitstests (EUCAST) für Amoxicillin/Clavulansäure festgelegt und sind hier aufgeführt: https://www.ema.europa.eu/documents/other/minimum-inhibitory-concentration-mic- breakpoints_en.xlsx
Die Prävalenz von Resistenzen kann für einzelne Spezies geographisch und über die Zeit schwanken, und Informationen zu lokalen Resistenzen werden insbesondere bei der Behandlung schwerer Infektionen benötigt. Im Bedarfsfall ist der Rat eines Experten einzuholen, wenn der Nutzen der Substanz zumindest bei einigen Infektionen aufgrund der lokalen Prävalenz von Resistenzen fraglich ist.
| Üblicherweise empfindliche Erreger |
| Aerobe Gram-positive Mikroorganismen
Enterococcus faecalis Gardnerella vaginalis Staphylococcus aureus (Methicillin-empfindlich) £ Koagulase-negative Staphylococci (Methicillin-empfindlich) Streptococcus agalactiae Streptococcus pneumoniae1 Streptococcus pyogenes und andere betahämolysierende Streptokokken Streptococcus-viridans-Gruppe Aerobe Gram-negative Mikroorganismen Capnocytophaga spp. Eikenella corrodens Haemophilus influenzae2 Moraxella catarrhalis Pasteurella multocida Anaerobe Mikroorganismen Bacteroides fragilis Fusobacterium nucleatum Prevotella spp. |
| Spezies, bei denen eine erworbene Resistenz ein Problem darstellen kann |
| Aerobe Gram-positive Mikroorganismen
Enterococcus faecium $ Aerobe Gram-negative Mikroorganismen Escherichia coli Klebsiella oxytoca Klebsiella pneumoniae Proteus mirabilis Proteus vulgaris |
| Von Natur aus resistente Organismen |
| Aerobe Gram-negative Mikroorganismen
Acinetobacter sp. Citrobacter freundii Enterobacter sp. Legionella pneumophila Morganella morganii Providencia spp. Pseudomonas sp. Serratia sp. Stenotrophomonas maltophilia Andere Mikroorganismen Chlamydophila pneumoniae Chlamydophila psittaci Coxiella burnetti Mycoplasma pneumoniae |
| $ Natürliche intermediäre Empfindlichkeit in Abwesenheit von erworbenen Resistenzmechanismen.
£ Alle Methicillin-resistenten Staphylokokken sind gegenüber Amoxicillin/Clavulansäure resistent. 1 Streptococcus pneumoniae, der gegenüber Penicillin resistent ist, sollte mit dieser Formulierung von Amoxicillin/Clavulansäure nicht behandelt werden (siehe Abschnitte 4.2 und 4.4). 2 In manchen Ländern der EU wurde über Stämme mit einer verringerten Empfindlichkeit mit einer Häufigkeit von mehr als 10% berichtet |
5.2 Pharmakokinetische Eigenschaften
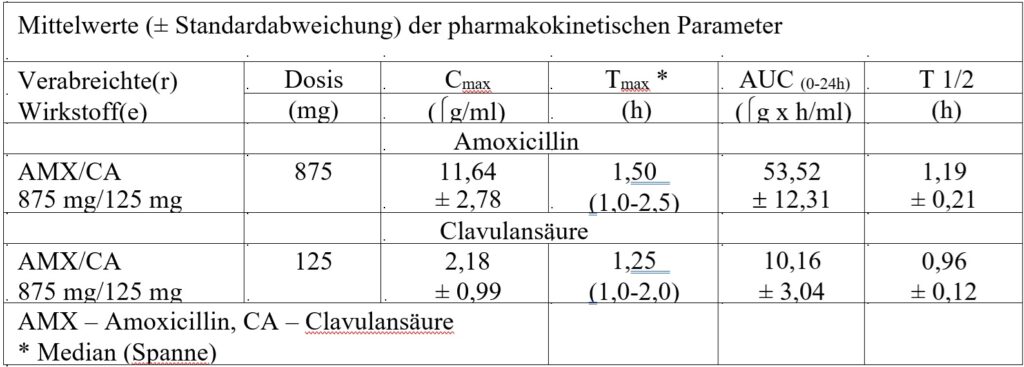
Resorption
Amoxicillin und Clavulansäure sind in wässriger Lösung bei physiologischem pH-Wert vollständig gelöst. Beide Bestandteile werden nach oraler Verabreichung schnell und gut resorbiert. Die Bioverfügbarkeit von Amoxicillin und Clavulansäure liegt nach oraler Verabreichung bei etwa 70 %. Die Plasmaprofile der beiden Bestandteile ähneln sich, die Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) beträgt in beiden Fällen etwa eine Stunde.
Im Folgenden werden die pharmakokinetischen Ergebnisse aus einer Studie dargestellt, in denen gesunde Probanden im Nüchternzustand Amoxicillin/Clavulansäure (875 mg/125 mg Tabletten zweimal täglich) erhielten.
Die durch Amoxicillin/Clavulansäure erzielten Amoxicillin- und Clavulansäure- Serumkonzentrationen sind mit denen vergleichbar, die durch orale Verabreichung äquivalenter Dosen an Amoxicillin oder Clavulansäure allein erreicht werden.
Verteilung
Etwa 25 % der gesamten im Plasma auftretenden Clavulansäure und 18 % des gesamten im Plasma auftretenden Amoxicillins sind an Proteine gebunden. Das scheinbare Verteilungsvolumen beträgt etwa 0,3–0,4 l/kg für Amoxicillin und etwa 0,2 l/kg für Clavulansäure.
Nach intravenöser Verabreichung wurden sowohl Amoxicillin als auch Clavulansäure in der Gallenblase, im abdominellen Gewebe, in der Haut, im Fettgewebe, im Muskelgewebe, in der Synovial- und Peritonealflüssigkeit, in der Gallenflüssigkeit und im Eiter nachgewiesen. Amoxicillin verteilt sich nicht in ausreichendem Maße in die Zerebrospinalflüssigkeit.
Tierexperimentelle Studien ergaben für keinen der Bestandteile Hinweise auf eine signifikante Geweberetention der jeweiligen Metaboliten. Amoxicillin ist, wie die meisten Penicilline, in der Muttermilch nachweisbar. Clavulansäure tritt ebenfalls in Spuren in der Muttermilch auf.
Es wurde gezeigt, dass sowohl Amoxicillin als auch Clavulansäure die Plazentaschranke passieren (siehe Abschnitt 4.6).
Biotransformation
Amoxicillin wird teilweise als inaktive Penicilloinsäure im Urin ausgeschieden, und zwar in einem Ausmaß von bis zu 10 bis 25 % der Initialdosis. Clavulansäure wird beim Menschen weitgehend metabolisiert und im Urin und Stuhl eliminiert sowie als Kohlendioxid ausgeatmet.
Elimination
Amoxicillin wird hauptsächlich über die Nieren ausgeschieden, während Clavulansäure sowohl über renale als auch über nicht-renale Mechanismen ausgeschieden wird.
Amoxicillin/Clavulansäure hat bei gesunden Probanden eine mittlere Eliminationshalbwertzeit von etwa einer Stunde und eine mittlere Gesamt-Clearance von etwa 25 l/h. Etwa 60 bis 70 % des Amoxicillins und etwa 40 bis 65 % der Clavulansäure werden in den ersten 6 Stunden nach Verabreichung einzelner Augmentin 250 mg/125 mg oder 500 mg/125 mg Tabletten unverändert im Urin ausgeschieden. Unterschiedliche Studien zeigten, dass über den Zeitraum von 24 Stunden 50– 85 % des Amoxicillins und 27–60 % der Clavulansäure über den Urin ausgeschieden werden. Bei Clavulansäure wird die größte Menge in den ersten beiden Stunden nach der Verabreichung ausgeschieden.
Die gleichzeitige Anwendung von Probenecid verzögert die Amoxicillin-Exkretion, nicht aber die renale Exkretion von Clavulansäure (siehe Abschnitt 4.5).
Alter
Die Eliminationshalbwertzeit von Amoxicillin ist bei kleinen Kindern im Alter von etwa 3 Monaten
bis 2 Jahren ähnlich wie diejenige bei älteren Kindern und Erwachsenen. Für sehr kleine Kinder (einschließlich Frühgeborene) sollte der Abstand der Gaben in der ersten Lebenswoche eine zweimal tägliche Gabe nicht überschreiten, da die Elimination über die Niere noch nicht vollständig ausgebildet ist. Da bei älteren Patienten die Wahrscheinlichkeit einer eingeschränkten Nierenfunktion höher ist, ist die Dosis mit Vorsicht zu wählen, und eine Überwachung der Nierenfunktion kann ratsam sein.
Geschlecht
Nach oraler Verabreichung von Amoxicillin/Clavulansäure an gesunde männliche und weibliche Probanden hatte das Geschlecht keinen signifikanten Einfluss auf die Pharmakokinetik von Amoxicillin oder Clavulansäure.
Eingeschränkte Nierenfunktion
Die Gesamt-Serumclearance von Amoxicillin/Clavulansäure nimmt proportional mit der Einschränkung der Nierenfunktion ab. Die Abnahme der Arzneimittel-Clearance ist bei Amoxicillin ausgeprägter als bei Clavulansäure, da ein höherer Anteil von Amoxicillin über die Nieren ausgeschieden wird. Daher muss die Dosierung bei eingeschränkter Nierenfunktion eine übermäßige Akkumulation von Amoxicillin verhindern, während adäquate Konzentrationen an Clavulansäure erhalten bleiben müssen (siehe Abschnitt 4.2).
Eingeschränkte Leberfunktion
Patienten mit eingeschränkter Leberfunktion sollten mit Vorsicht dosiert werden, und die Leberfunktion sollte in regelmäßigen Abständen überwacht werden.
5.3 Präklinische Daten zur Sicherheit
Basierend auf Studien zur Sicherheitspharmakologie, Reproduktionstoxizität und Gentoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In an Hunden durchgeführten Studien zur Toxizität bei wiederholter Gabe von Amoxicillin/Clavulansäure kam es zu Magenreizung und Erbrechen sowie zu einer Verfärbung der Zunge.
Es wurden keine Studien zum kanzerogenen Potenzial von Amoxicillin/Clavulansäure oder seinen Komponenten durchgeführt.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Tablettenkern : Magnesiumstearat, Carboxymethylstärke-Natrium, kolloidales wasserfreies Siliciumdioxid, mikrokristalline Cellulose.
Filmüberzug: Titandioxid (E171), Hypromellose, Macrogol (4000, 6000), Dimeticon.
6.2 Inkompatibilitäten
Keine bekannt.
6.3 Dauer der Haltbarkeit
2 Jahre.
Tabletten aus Beutelpackungen mit Trockenmittel sollen innerhalb von 30 Tagen nach dem Öffnen verbraucht werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren um den Inhalt vor Feuchtigkeit zu schützen. Nicht über 25°C lagern.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium/Polyamid Laminat mit Deckfolie aus Aluminium bezeichnet als kaltverformter Aluminiumblister (CFB) mit 2, 4, 10, 12, 14, 16, 20, 24, 30, 100 oder 500 Tabletten.
Aluminium PVC/PVdC Blister in einem Aluminiumlaminat Beutel mit Trocknungsmittel (Beutelpackung mit Trockenmittel, DPP) mit 14 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend der nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
GlaxoSmithKline Pharma GmbH, Wien
8. Zulassungsnummer
1-21396
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
Datum der Erteilung der Zulassung: 04.04.1996
Datum der letzten Verlängerung der Zulassung: 19.10.2014
10. Stand der Information
05/2024
Rezeptpflicht/APOTHEKENPFLICHT
Rezept- und apothekenpflichtig, wiederholte Abgabe verboten.