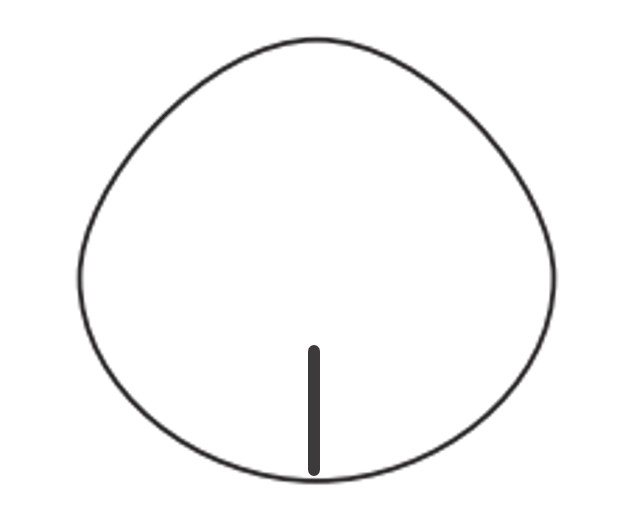
Bei den gelgefüllten Brustimplantaten von MENTOR® handelt es sich um Silikonelastomer-Mammaimplantate. Die gelgefüllte Hülle ist aus mehreren quer vernetzten Silikonelastomer-Lagen aufgebaut, um dem Implantat die nötige Elastizität und Integrität zu verleihen.
Mentor bietet gelgefüllte Brustimplantate mit zwei verschiedenen Oberflächen an: mit SILTEX™ und glatter Oberfläche. Die SILTEX™ Hülle verfügt über eine texturierte Oberfläche für die Kollagenanlagerung. Alle gelgefüllten Brustimplantate von MENTOR® enthalten kohäsives Silikongel. Mentor bietet gelgefüllte Brustimplantate mit kohäsivem Füllmaterial in unterschiedlichen Stärken an. Die Produkte sind in runder Form mit unterschiedlichen Projektionen und in zahlreichen verschiedenen anatomischen Formen mit unterschiedlichen Höhen und Projektionen erhältlich. Das auf der Verpackung angegebene Volumen entspricht dem Füllvolumen des Gels.
INDIKATIONEN
Für diese Implantate gelten die folgenden Indikationen:
- Kosmetische Brustaugmentation. Das Europäische Parlament „empfiehlt die Verwendung von Implantaten bei Frauen unter 18 Jahren nur bei medizinischer Indikation.“
- Primäre oder sekundäre Brustrekonstruktion nach Mastektomie.
- Rekonstruktion aufgrund anderer Arten der Krebsbehandlung.
- Revision aufgrund von Komplikationen oder anderen unerwünschten Ergebnissen einer vorhergegangenen Mastektomie oder von anderen Arten der Krebsbehandlung.
- Posttraumatisch infolge der Total- oder Teilentfernung der Brust/Brüste durch Operation (aus einem beliebigen Grund) oder infolge der Verletzung selbst.
- Angeborene Fehlbildungen: Pectus excavatum als kongenitale konkave Brustwanddeformität mit Anomalien des Brustbeins und der vorderen Rippen; Pectus carinatum als kongenitalekonvexe Brustwanddeformität mit Anomalien des Brustbeins und der vorderen Rippen; starke Asymmetrie, die sich durch einen angeborenen oder erworbenen erheblichen Größenunterschied der Brüste im Sinne einer wesentlichen körperlichen Fehlbildung (z. B. Poland-Syndrom) äußert.
- Schwere Ptosis, die einen spezifischen Rekonstruktionseingriff erfordert (z. B. Mastopexie).
- Patientinnen, bei denen auf Grund einer starken Deformität − verursacht durch medizinische oder chirurgische Komplikationen − ein Implantat-Austausch erforderlich ist, unabhängig von der ursprünglichen Indikation zur Implantation und von der Art des ursprünglich eingesetzten Implantats.
- Patientinnen, bei denen auf Grund der Operation der betroffenen Brust wegen einer der oben angeführten Indikationen eine Augmentation der nicht betroffenen Brust erforderlich ist (z. B. einseitige Mastektomie mit Vergrößerung der anderen Brust aus Gründen der Symmetrie).
- Ersatz- oder Revisionsoperation bei Patientinnen, die zur Brustvergrößerung oder Brustrekonstruktion mit Silikongel oder Kochsalzlösung gefüllte Implantate erhalten haben.
KONTRAINDIKATIONEN
Nicht indiziert sind diese Implantate für Patientinnen, auf die eine oder mehrere der folgenden Aussagen zutreffen:
- Schwangerschaft oder Stillzeit
- Lupus erythematodes (z. B. SLE und DLE)
- Sklerodermie (z. B. progressive systemische Sklerose)
- Aktueller körperlicher Zustand, der die Wundheilung beeinträchtigen oder komplizieren könnte (außer bei Brustrekonstruktionen)
- Infektion oder Abszess an einer beliebigen Körperstelle
- Gewebeeigenschaften, die auf Grund ihrer Beschaffenheit klinisch ungeeignet für das Implantat sind (z. B. Gewebeschädigung infolge Bestrahlung, unzureichendes Gewebe oder beeinträchtigte Vaskularität)
- Aktueller körperlicher Zustand oder Behandlung wegen eines Zustands, der nach Meinung der behandelnden Ärzte ein nicht vertretbares Operationsrisiko darstellt
- Anatomische oder physiologische Anomalien, die zu erheblichen postoperativen Komplikationen führen können
- Empfindlichkeit gegen Fremdkörper oder wiederholte erfoIglose Versuche einer Brustaugmentation oder -rekonstruktion in der Vorgeschichte
- Ablehnung einer Revisionsoperation
- Unrealistische Erwartungshaltung, wie zum Beispiel ungeeignete Einstellung oder Beweggründe und mangelndes Verständnis der mit der Operation und dem Implantat verbundenen Risiken
- Präkanzeröse Brusterkrankung ohne subkutane Mastektomie
- Unbehandelte oder unzureichend behandelte bösartige Brusterkrankung ohne Mastektomie.
HINWEIS: Für ein zufriedenstellendes Ergebnis bei der Verwendung dieses gelgefüllten Implantats als Gewebeersatz nach Mastektomie oder Trauma können spezielle rekonstruktive Verfahren erforderlich sein, vor allem bei Vorliegen von Strahlungsschäden an der Thoraxwand, gespannter Haut im Brustwandbereich, nach Hautverpflanzungen am Thorax oder radikaler Resektion des großen Brustmuskels.
KLINISCHE VORTEILE
Die Brustaugmentation ist ein chirurgisches Verfahren, bei dem die Brüste aus ästhetischen Gründen vergrößert werden können. Die Brustrekonstruktion ist ein chirurgisches Verfahren, bei dem Brustgewebe ersetzt wird, das wegen Krebs oder einer Verletzung entfernt wurde, oder um Brustgewebe zu ersetzen, das sich wegen einer schweren Brustanomalie nicht normal entwickeln konnte.
AUFKLÄRUNG UND EINWILLIGUNGSERKLÄRUNG DER PATIENTIN
Die Implantation von gelgefüllten Brustimplantaten kann mit Komplikationen und Risiken verbunden sein. Der Einsatz dieses Produkts ist ein Wahleingriff. Die Patientin muss vor der Operation über die Vorteile und möglichen Risiken einer Geweberekonstruktion und/oder Brustvergrößerung mit Mammaimplantaten und über alternative Verfahren aufgeklärt werden. Die Patientin muss darauf hingewiesen werden, dass nicht mit einer lebenslangen Haltbarkelt des Implantats zu rechnen ist und dass u. U. eine Revisionsoperation erforderlich sein kann, einschließlich Entfernung
und Austausch des Implantats. Die Ärzte in den Mitgliedsstaaten der Europäischen Union (EU) und in Australien sind verpflichtet, jeder prospektiven Patientin die Mentor Patientenbroschüre mit dem Titel: „Gel-Filled Breast Implant Surgery: Making an Informed Decision” (Gelgefüllte Brustimplantate –Informationen zur Entscheidung) auszuhändigen. Diese Broschüre soll Patientinnen dabei unterstützen, bei Brustaugmentationen und Brustrekonstruktionen eine wohlüberlegte Entscheidung zu treffen. Im hinteren Teil der Patientenbroschüre befindet sich ein Unterschriftsformular
für Patientinnen. In den Mitgliedsstaaten der Europäischen Union (EU) und in Australien müssen alle Patientinnen vor dem Eingriff die Patientenbroschüre gelesen, verstanden und das Unterschriftsformular unterzeichnet haben. Dem Chirurgen obliegt die Wahl der für die jeweilige Patientin am besten geeigneten präoperativen Aufklärung. Mentor setzt voraus, dass der Chirurg die Patientin über alle mit der Implantation eines Brustimplantats verbundenen potenziellen Komplikationen und Risiken unterrichtet.
Nach der Operation muss der Arzt die Patientin über die notwendigen postoperativen Praxisbesuche informieren und auf die Notwendigkeit hinweisen, weiterhin einen Arzt für routinemäßige Vorsorgeuntersuchungen auf Brustkrebs zu konsultieren. Die Patientinnen sind darauf hinzuweisen, im Falle einer geplanten Operation im Brustbereich einen Arzt oder Chirurgen auf das Vorhandensein eines Implantats hinzuweisen und vor der Anwendung von topischen Medikamenten wie Steroiden im Brustbereich einen Arzt oder Apotheker zu konsultieren. Darüber hinaus ist die Patientin anzuweisen, bei Problemen in Zusammenhang mit ihren Brustimplantaten ihren Chirurgen zu kontaktieren.
GEBRAUCHSANWEISUNG
Die chirurgischen Methoden der Implantation von gelgefüllten Implantaten für Brustrekonstruktionen oder allgemeine kosmetische Mammavergrößerungen sind vielfältig; aus diesem Grunde wird dem Chirurgen empfohlen, nach dem Verfahren vorzugehen, das sich nach seiner praktischen Erfahrung und nach seinem Ermessen am besten für die Patientin eignet. Die nachstehend aufgeführten Verfahren werden von Mentor für gelgefüllte Implantate empfohlen.
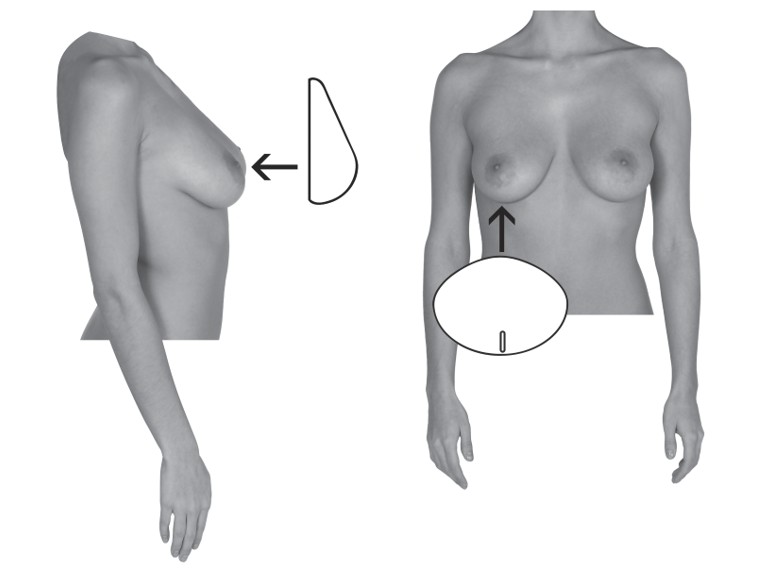
Auswahl des Implantats
Unter anderem müssen folgende wichtige Aspekte bezüglich der chirurgischen Verfahren und der Dimensionierung des Implantats berücksichtigt werden:
- Das Implantat darf im Vergleich zu den Abmessungen der Brustwand der Patientin nicht zu klein und nicht zu groß sein.
- Das verfügbare Gewebe muss das Implantat angemessen abdecken.
- Bei Patientinnen mit dünnem oder mangelhaftem Gewebe sollte einer submuskulären Platzierung des Implantats der Vorzug gegeben werden.
- Es muss eine gut ausgeformte, trockene Tasche von angemessener Größe und Symmetrie geschaffen werden, damit das Implantat flach aufliegend auf einer glatten Oberfläche positioniert werden kann.
Nur Contour Profile:
Das SILTEX™ CONTOUR PROFILE™ gelgefüllte (CPG™ Gel) Brustimplantat Cohesive III verfügt auf der Vorder- und Rückseite des Implantats über erhöhte Orientierungsmarkierungen. Diese Markierungen helfen dem Arzt bei der Ausrichtung des Implantats und gewährleisten eine korrekte Platzierung bei der Implantation.
Brustimplantat – hintere Orientierungsmarkierungen
HINWEIS: Es empfiehlt sich, während der Operation Implantate verschiedener Größen bereitzuhalten, um ausreichende Flexibilität bei der Auswahl der geeigneten Implantatgröße zu gewährleisten. Auch ein Ersatzimplantat sollte zur Verfügung stehen.
In der medizinischen Fachliteratur wird empfohlen, bei Patientinnen mit Silikonimplantaten eine Antibiotikaprophylaxe bei Zahn- oder anderen chirurgischen Eingriffen durchzuführen.
Die Patientin ist speziell im Hinblick auf jegliche Art von allergischen Reaktionen auf das Implantatmaterial und die Füllmittel in der Vergangenheit zu befragen. Prüfverfahren für gelgefüllte Brustimplantate
Das Implantat muss unmittelbar vor der Verwendung auf seine strukturelle Integrität und die Unversehrtheit der Hülle geprüft werden. Dies kann mittels leichtem Druck mit Hand und Fingern durchgeführt werden. Dabei ist sorgfältig darauf zu achten, ob Gel austritt.
Dokumentationsverfahren für gelgefüllte Brustimplantate
Jedem Implantat sind zwei Patientendaten-Aufkleber beigefügt, auf denen die Katalognummer, die Chargennummer und die Seriennummer (falls zutreffend) für dieses Implantat angegeben sind. Einer dieser druckempfindlichen Aufkleber sollte auf das Krankenblatt der Patientin geklebt werden. Die Implantatposition (Iinke oder rechte Brust) und das Operationsdatum müssen auf dem Etikett eingetragen werden.
HERSTELLUNG
Bei der Herstellung des Produkts werden keine Komponenten/Materialien verwendet, die Phthalat enthalten. Des Weiteren enthält das Produkt kein Latex und stand während der Herstellung nicht mit Produkten in Kontakt, die Latex enthalten. Außerdem wird das Produkt nicht unter Verwendung von Gewebe tierischen Ursprungs hergestellt.
REINIGUNG UND STERILISATION
MENTOR® gelgefüllte Brustimplantate werden einzeln in einem sterilen und nicht-pyrogenen doppelten Verpackungssystem geliefert. Die doppelte Verpackung erleichtert den Transport des Produktes aus dem Versorgungsbereich in den sterilen Bereich. Die Sterilität kann nicht garantiert werden, wenn das doppelte Verpackungssystem beschädigt wurde. Das Produkt nicht verwenden, wenn die Sterilbarriere beeinträchtigt oder das Produkt beschädigt ist; in einem solchen Fall die zuständige Mentor-Vertretung benachrichtigen. Dieses Produkt wurde mittels Hitzesterilisation (trocken) sterilisiert. Das Implantat nicht erneut sterilisieren.
Alle Gel-Brustimplantate von MENTOR® sind zum Gebrauch bei einer einzigen Patientin in einem einzigen Eingriff bestimmt. Falls ein Produkt entgegen den Anweisungen des Herstellers erneut verwendet wird, besteht das Risiko von Infektionen (mikrobieller Art sowie durch Viren und andere übertragbare Erreger) und von Immunreaktionen. Die Sterilität des Produkts ist dann nicht mehr gewährleistet. Des Weiteren kann aufgrund des Beschädigungsrisikos für das Implantat die Integrität des Produkts nicht garantiert werden. Falls die Bestimmung zum ausschließlichen einmaligen Gebrauch nicht befolgt wird, ist die festgelegte Haltbarkeitsdauer der Produkte beeinträchtigt und damit ungültig. Sterilität, Sicherheit und Funktionsfähigkeit können bei beschädigten Implantaten nicht garantiert werden. Falls das Produkt kontaminiert wird, wenden Sie sich an Ihre Mentor-Vertretung vor Ort (siehe PRODUKTRÜCKGABE).
INFORMATIONEN ZU LAGERUNG, HANDHABUNG UND ENTSORGUNG DER VERPACKUNG
Es müssen keine speziellen Bedingungen bei der Lagerung dieses Produkts erfüllt werden. Das Produkt wurde bei einem Schnellalterungsversuch extremen Temperatur-und Feuchtigkeitswerten ausgesetzt und anschließend geprüft. Befolgen Sie gültige Verordnungen und Vorgaben der Recyclingprogramme für die Entsorgung oder das Recycling des Verpackungsmaterials. Mentor verlangt, dass Produkte, die in Zusammenhang mit einer Produktreklamation oder einem unerwünschten Ereignis explantiert wurden, an den Hersteller (Mentor) zurückgesendet werden. Siehe auch den Abschnitt zur Produktbewertung unten.
VORSICHTSMASSNAHMEN
Es obliegt der Verantwortung des Chirurgen, die Patientin oder ihre Vertreter vor der Operation über mögliche Komplikationen bei der Verwendung dieses Produktes zu informieren.
- Eine vorhandene Infektion muss vor Implantation der Prothese behandelt werden und vollständig ausgeheilt sein.
- Jedem Chirurgen, der Brustvergrößerungen oder -rekonstruktionen mit Hilfe von Implantaten durchführt, soIlten die aktuellen Techniken der Körpervermessung, der Bestimmung dergeeigneten Implantatgröße und der operativen Vorgehensweise geläufig sein. (Siehe Abschnitt GEBRAUCHSANWEISUNG in dieser Anleitung.)
- Die Hülle aus Silikonelastomer kann leicht beschädigt werden, beispielsweise durch einen Schnitt mit einem Skalpell oder durch einen Einriss aufgrund zu hoher Druck- und Zugbelastung sowie durch die Manipulation mit stumpfen Instrumenten oder durch Durchstechen mit Nadeln. Dies hat ein Reißen des Implantats zur Folge. Alle Prothesen müssen vor und während der Implantation sorgfältig auf ihre Unversehrtheit überprüft werden. Bei der Handhabung und beim Einsetzen des Implantats ist mit größter Umsicht vorzugehen.
- Beim Einsetzen des Implantats keine zu große Kraft ausüben und das Implantat nicht übermäßig manipulieren, da es dadurch beschädigt werden könnte.
- Jeder spätere chirurgische Eingriff in der Umgebung des Implantats muss mit äußerster Vorsicht erfolgen, um eine Beschädigung des Implantats zu vermeiden. Falls das Implantat beschädigt wird, muss es entfernt werden.
- Jedes Implantat muss vor der Operation überprüft und während des chirurgischen Eingriffs ständig überwacht werden, um die Unversehrtheit des Implantats sicherzustellen. Wurden ander ursprünglichen Form des Implantats Änderungen vorgenommen, darf es nicht mehr implantiert werden. Ein beschädigtes Implantat oder ein Implantat, an dem Reparaturen oder Änderungen vorgenommen wurden, darf nicht implantiert werden. Während der Operation ist ein Ersatzimplantat bereitzuhalten.
- Das Implantat darf nicht mit Kondensator-Einweg-Elektrokautern in Berührung kommen, da hierdurch die Außenhülle des Implantats beschädigt werden kann.
Zusätzliche Vorsichtsmaßnahmen für gelgefüllte SILTEX™ Brustimplantate
- Eine zu kleine Inzision ist zu vermeiden. Gegebenenfalls ist eine längere Schnittführung als bei anderen Mammaimplantaten mit glatter Oberfläche erforderlich, um die Implantation zu erleichtern und eine Beschädigung des Implantats zu vermeiden. Ein Implantat, das beim Einsetzen beschädigt wurde, kann postoperativ rupturieren.
- Mentor empfiehlt dem Chirurgen bei der Wahl der optimalen Schnittlänge und der chirurgischen Vorgehensweise die Größe des Implantats, die festere Beschaffenheit und das höhere Profil der SILTEX™ HüIIe zu berücksichtigen. (Weitere Informationen hierzu finden Sie auch im Abschnitt Auswahl des Implantats in dieser Anleitung.)
Perioperative Maßnahmen zur Vermeidung von Infektions- und Entzündungsquellen:
Die folgenden perioperativen Maßnahmen können dazu beitragen, bakterielle Infektionen und Entzündungen durch Fremdkörper zu vermeiden:
- Einen schichtweisen Wundverschluss durchführen, sodass Bakterien von der Haut/Wunde nicht in die Implantathöhle gelangen.
- Möglichst eine Taschenpräparation vermeiden, bei der es zu Kontakt mit den Milchkanälen und -drüsen kommt.
- Unnötige Verletzungen des umliegenden Gewebes vermeiden und bei der Vorbereitung der Implantattasche auf eine sorgfältige anhaltende Hämostase achten.
- Intraoperativen Kontakt mit dem Sizer sowie Hautkontakt und Anpassversuche zur Größenbestimmung der Implantattasche auf ein Minimum reduzieren.
- Eine präoperative intravenöse Antibiose zur Prophylaxe anwenden.
- aseptische Verfahren strikt eingehalten werden. Instrumente und Handschuhe sollten vor dem Umgang mit dem Implantat von Verunreinigungen saubergespült werden.
- Fusseln, Staub, Talkum, Puder von OP-Handschuhen, Stoff- und Schwammfusseln, Fingerabdrücke, Hautöle und andere Verunreinigungen, die sich durch unsachgemäße Behandlung auf der Oberfläche des Implantats ablagern, können zu Fremdkörperreaktionen führen. Um eine Verunreinigung des Implantats und mögliche Komplikationen zu verhindern, müssen saubere, aseptische Verfahren strikt eingehalten werden. Instrumente und Handschuhe sollten vor dem Umgang mit dem Implantat von Verunreinigungen saubergespült werden. sowie die festere Beschaffenheit und das höhere Profil der SILTEX™ Hülle zu berücksichtigen. (Weitere Informationen hierzu finden Sie auch im Abschnitt Auswahl des Implantats in dieser Anleitung.)
Contour Profile
- Darauf achten, dass die Tasche nicht zu groß ist, da dies eine zu starke Bewegung oder Rotation des Implantats zur Folge haben kann.
- Mentor empfiehlt dem Chirurgen bei der Wahl der optimalen Schnittlänge und der chirurgischen Vorgehensweise die festere Beschaffenheit des Gels, die Größe des Implantats
WARNHINWEISE
Es obliegt der Verantwortung des Chirurgen (und davon geht Mentor aus), die Patientinnen über alle mit dem vorgeschlagenen chirurgischen Verfahren und dem Implantat verbundenen möglichen Risiken und Komplikationen zu informieren und diese im Vergleich mit Risiken und Komplikationen alternativer Verfahren darzustellen. Die Patientin muss darauf hingewiesen werden, dass nicht mit einer lebenslangen Haltbarkeit des Implantats zu rechnen ist.
- Es muss sorgfältig darauf geachtet werden, dass das Implantat nicht durch chirurgische Instrumente beschädigt wird. Bei einer Beschädigung kann die Hülle sofort oder zeitlich verzögert reißen. Häufig ist es von Vorteil, zunächst eine tiefe Naht vorzulegen, um dadurch zu verhindern, dass eine Operationsnadel versehentlich mit dem Implantat in Berührung kommt und es dabei beschädigt wird.
- Dieses Produkt ist zur Verwendung bei einer einzigen Patientin in einem einzigen Eingriff Das Implantat kann beschädigt oder eine Infektion kann hervorgerufen werden, wenn im Bereich des Implantats zu einem späteren Zeitpunkt Eingriffe vorgenommen werden (zum Beispiel eine offene Kapsulotomie, Korrektur der präparierten Tasche usw.). DieEntscheidung, ob ein neues Implantat einzusetzen ist, liegt bei dem behandelnden Arzt. Wenn das Implantat beschädigt ist, muss es entfernt werden.
- Durch die semipermeable äußere Silikonhülle kann Silikongel in die Kapsel und das benachbarte Brustgewebe gelangen. Ein Übertritt in Kapillaren ist ebenfalls aufgetreten.Langzeitauswirkungen dieses Silikon-Austritts (Bleeding) sind nicht bekannt. Die Patientin ist auf diese mögliche Komplikation hinzuweisen. (Siehe auch den Abschnitt NEBENWIRKUNGEN/KOMPLIKATIONEN in dieser Anleitung.)
- In jede Brust darf nur ein Implantat eingesetzt werden. Mentor rät davon ab, mehrere Implantate übereinander einzusetzen. Die Implantate wurden für diese Art der Anwendung nicht geprüft und es kann keine Garantie für ihre Unversehrtheit übernommen werden, da das Material Reibung und Verschleiß unterliegen kann. Eine solche unübliche Beanspruchung kann bei dem Implantat zu einer Schwächung der Hülle oder Rissbildung führen.
- Ein beschädigtes oder verändertes Implantat darf weder eingesetzt noch darf ein Reparaturversuch an diesem Implantat unternommen werden. Die Wirkung von Medikamenten (z. B. Antibiotika und Steroide) auf das Implantat ist vom Hersteller noch nicht untersucht worden; daher wird von einer Anwendung abgeraten. Jeder Arzt,der sich für die Verabreichung von chemotherapeutischen Medikamenten in Verbindung mit dem Implantat entscheidet, muss sich zuvor vergewissern, dass sich das Medikament mit dem Silikonelastomer verträgt.
- In das Implantat dürfen keine Medikamente oder anderen Substanzen eingebracht oder injiziert werden. Bei Injektionen durch die Außenhülle des Implantats wird das Produkt beschädigt.
- Falls am Einsatzort des Implantats Povidon-Jodlösung eingesetzt wird, muss die Stelle sorgfältig mit Kochsalzlösung gespült werden, um Reste der Lösung zu entfernen.
- Bei der präoperativen Planung hinsichtlich der Implantatform und -größe sowie seiner Platzierung muss für eine spannungsfreie Gewebeabdeckung eine bestimmte Zugabe berücksichtigtwerden. Druck, Kraft, Zug und andere Belastungen, die im Implantationsbereich wirken, sind ebenfalls zu berücksichtigen.
- Durch jegliche implantierte Fremdkörper können Sepsis, Hämorrhagie und Thrombosen hervorgerufen werden.
- Nach der Anwendung von Mikrowellen-Diathermie bei Patientinnen mit Brustimplantaten sind Fälle von Nekrose, Hauterosion und Extrusion des Implantats aufgetreten. Daher wird von deren Einsatz bei Patientinnen mit Brustimplantaten abgeraten.
- Die Patientin ist darauf hinzuweisen, dass jegliche extreme Belastung oder Verletzung der Brust zu einer Rissbildung im Implantat führen kann.
- Mentor rät dringend von der Behandlung einer Kapselverhärtung unter Einsatz einer starken externen Belastung (wie zum Beispiel eine geschlossene Kapsulotomie) ab und übernimmt für den Fall, dass der Chirurg sich dennoch für einen solchen Eingriff entscheidet, keinerlei Verantwortung für die strukturelle Integrität des Implantats. Wenn der Arzt dieses Verfahrenanwendet, können verschiedene Komplikationen auftreten: Hämatome, Verlagerung des Implantats und/oder Ruptur der Hülle. Die Patientin muss vom Arzt über diese möglichen Komplikationen sowie über Alternativen zu diesem Verfahren informiert werden. Die beschriebene extreme Belastung oder Verletzung der Brust und des Implantats können eine Ruptur des Implantats zur Folge haben.
- Mentor hat die In-vivo-Auswirkungen einer Bestrahlung von Patientinnen mit Brustimplantaten nicht untersucht; in der Fachliteratur wird jedoch berichtet, dass eine Strahlentherapie die Wahrscheinlichkeit des Auftretens einer Kapselkontraktur vergrößern kann.1 Darüber hinaus werden in der medizinischen Fachliteratur folgende Auswirkungen der Strahlentherapie bei Patientinnen mit Brustimplantaten erwähnt: „(a) Wenn keine fibrotische Gewebereaktion nach dem Einsatz eines Brustimplantats auftrat, zeigte die Strahlentherapie akzeptable Ergebnisse; (b) Soweit vertretbar, schien eine Dosis von 45 Gy über einen Zeitraum von 5 Wochen höheren Dosen überlegen; (c) Es wurde beobachtet, dass eine unmittelbar auf die Brustrekonstruktion folgende Bestrahlung zu einem schlechteren kosmetischen Ergebnis führen kann.“2 0b im Anschluss an die Implantation eine Strahlentherapie durchgeführt werden sollte, muss von dem Chirurgen und dem Radioonkologen entschieden werden.
- Ein periumbilikaler Zugang bei der Implantation hat sich nicht durchgesetzt und ist nicht zu empfehlen.
- Eine sorgfältige Blutstillung ist erforderlich, um eine postoperative Hämatombildung zu vermeiden. Sollte sich eine starke Blutung nicht stillen lassen, ist vom Einsetzen des Implantatsabzusehen, bis die Blutung unter Kontrolle ist.
- Wird versucht, ein Hämatom oder ein Serom zu punktieren, oder wird eine Biopsie oder Lumpektomie durchgeführt, muss mit großer Vorsicht vorgegangen werden, um das Implantat nicht zu beschädigen. Bei den genannten Verfahren besteht immer die Gefahr einer Perforation.
- Die Extrusionshäufigkeit nimmt bei Implantaten zu, die in Bereiche mit Weichteilläsionen eingesetzt wurden. Dies ist bei Vernarbungen, stark bestrahltem oder verbranntem Gewebe,Knochenquetschungen oder früher vorgenommenen radikalen Reduktionsoperationen der Fall.
- Um ein Implantat, das mit Weichteilen in Berührung kommt, kann sich eine exzessive fibröse Kapsel bilden und/oder eine Kontraktur auftreten. Die Häufigkeit und Intensität dieser Vorgänge kann im Falle von postoperativer Iokaler Hämatombildung oder einer Infektion im Bereich des Implantats zunehmen.
- Die Verwendung der Implantate bei psychisch instabilen Patientinnen liegt im Ermessen des Arztes.
- Die chirurgische Implantation von Brustimplantaten kann die Stillfähigkeit beeinträchtigen. Das Institute of Medicine (IOM) kam zu dem Ergebnis, dass in begrenztem Umfang erwiesen ist,dass eine Implantation, besonders bei periareolärem Zugang, die Fähigkeit zur Milchbildung und zum Stillen beeinträchtigen kann. Es wird jedoch darauf hingewiesen, dass Operationen, die einer Brustrekonstruktion vorausgingen, zum Beispiel eine Mastektomie, die eigentliche Ursache für diese Beeinträchtigung sein können.
- Bei Patientinnen mit Erkrankungen des Bindegewebes kann das Risiko für Wunddehiszenz, Infektion und Blutungen (am ehesten aufgrund ihrer aktuellen medikamentösen Behandlung)erhöht sein. Bei diesen Patientinnen ist infolgedessen möglicherweise eine weitergehende Behandlung erforderlich.6
- Bei manchen Patientinnen mit Brustimplantaten sind neurologische und/oder rheumatologische Erkrankungen aufgetreten. Mentor erhebt derzeit entsprechende Daten, um diese potenziellen Risiken und ihren möglichen Zusammenhang mit Brustimplantaten weitergehend zu untersuchen.
- Die Patientinnen sollten sich von einem plastischen Chirurgen in Bezug auf ein Brustimplantat-assoziiertes anaplastisches großzelliges Lymphom (BIA-ALCL) untersuchen lassen, wenn es bei ihnen zu einer verzögert einsetzenden Serombildung in der Brust (verzögert einsetzend bedeutet mehr als 12 Monate nach der Implantation), einer neuen Raumforderung in der Brust oder zu einer Lymphadenopathie kommt. Weitere Informationen finden Sie im Abschnitt zum anaplastischen großzelligen Lymphom unten.
NEBENWlRKUNGEN/KOMPLlKATIONEN
Bei allen chirurgischen Eingriffen kann es zu unvorhergesehenen operativen und postoperativen Komplikationen kommen. Mögliche Reaktionen und Komplikationen, die mit der Verwendung von Brustimplantaten verbunden sein können, sind der Patientin vor der Operation darzulegen und zu erläutern. Es obliegt der Verantwortung des Chirurgen (und davon geht Mentor aus), die Patientin entsprechend zu informieren und die Vorteile/Risiken im Einzelfall abzuwägen.
RISIKEN DES VERFAHRENS
Alle chirurgischen Verfahren sind mit einem gewissen Komplikationsrisiko verbunden, das auf die Operation selbst sowie auf die Anästhesie zurückzuführen ist. Zu diesen Risiken gehören:
- Eine Infektion, erkennbar an Überwärmung, Schwellung, Schmerzempfindlichkeit, Rötung und Fieber, kann unmittelbar in der postoperativen Phase oder zu einem anderen Zeitpunkt nach der Implantation auftreten, ohne dass klassische Symptome vorhanden sind. Infektionen können ein toxisches Schocksyndrom (TSS) nach sich ziehen. Symptome des TSS sind unter anderem plötzliches Fieber, Erbrechen, Diarrhoe, Ohnmachtsanfälle, Schwindelgefühl und/oder ein sonnenbrandähnlicher Hautausschlag. Die Behandlung einer Infektion kann von der oralen oder intravenösen Verabreichung von Antibiotika bis zur chirurgischen Entfernung des Implantats reichen.
- Die Bildung von Hämatomen, die sich durch Schwellung, Druckempfindlichkeit und Verfärbung des Gewebes manifestieren, welches ggf. chirurgisch entfernt werden muss. Eine sorgfältige Blutstillung ist erforderlich, um eine postoperative Hämatombildung zu vermeiden.
- Die Bildung von Seromen ist relativ selten und manifestiert sich durch Anschwellen der Brust auf Grund einer Ansammlung von Serum in der Implantattasche, die ggf. chirurgisch entferntwerden muss. Sie kann kurz nach der Operation oder Jahre später auftreten; die Ätiologie ist ungeklärt.
- Des Weiteren bringt die Anästhesie Risiken mit sich.
SPEZIELL MIT BRUSTIMPLANTATIONEN VERBUNDENE RISIKEN
Kontraktur der Kapsel
Die Kapselkontraktur gehört zu den häufigsten Nebenwirkungen bei Brustimplantationen. Um das Implantat aufzunehmen, wird die chirurgische Tasche hinter der Brust etwas größer präpariert als das Implantat selbst. In der Regel bildet sich eine Hülle aus Narbengewebe um das Implantat herum, die manchmal so zusammenschrumpft, dass das Implantat gequetscht wird. Auf diese Weise kommt es zu einer mehr oder weniger ausgeprägten Verhärtung. Im schlimmsten Fall kann sich das Implantat hart anfühlen, Schmerzen bereiten und/oder sich verformen. Diese Kapselkontraktur kann schon kurze Zeit nach der Implantation auftreten oder erst Jahre später, sie kann unilateral, bilateral oder asymmetrisch sein. Eine chirurgische Korrektur oder Exzision der Narbe ist oft erfolgreich, jedoch ist ein wiederholtes Auftreten des Problems nicht unüblich. Die Ursache dieses Phänomens ist nur unzureichend geklärt. In der Vergangenheit war ein geschlossenes Lösen der Vernarbung durch Quetschen der Brust üblich, was heute allerdings selten praktiziert wird. Die Kapselkontraktur wird nach ihrem Ausmaß durch die Baker-Klassifizierung in die Grade I bis IV eingeteilt.
Darüber hinaus kann es zu einer Verkalkung der Kapsel kommen. Die Kalzifizierung ist ein Phänomen, das gelegentlich in Zusammenhang mit Langzeitvernarbung auftritt, vor allem bei Irritationen wie festen Verbrennungsnarben an Gelenken. Kalzifizierte Verkapselungen sollten entfernt werden, wenn die Patientin unter der Kontraktur leidet, sind ansonsten jedoch harmlos.
Kleine Kalkablagerungen werden im Brustparenchym häufig vorgefunden. In der Regel kann sie der Radiologe als gutartig beurteilen, zuweilen ist jedoch eine Biopsie erforderlich, um eine Bösartigkeit auszuschließen.
Ruptur des Implantats
Brustimplantate halten nicht unbedingt ein Leben lang. Auch wenn eine Ruptur nach der Implantation jederzeit auftreten kann, erbrachte eine Anzahl von Studien, bei denen Rupturen von runden und geformten gelgefüllten Brustimplantaten aus Silikon der aktuellen Generation verschiedener Hersteller, mit einfacher Hülle und CE-Kennzeichnung, mittels MRT zu verschiedenen Zeiten untersucht wurden, übereinstimmend ähnliche Ergebnisse, die darauf hindeuten, dass die durchschnittlich zu erwartende Lebensdauer mehr als 10 Jahre beträgt.
Obwohl sich gezeigt hat, dass das Silikonmaterial selbst nicht biologisch abgebaut wird, kann die Hülle auf Grund von Verschleiß oder direkter Verletzung reißen. Wenn die ImplantathülIe gerissen ist, wird das austretende Gel normalerweise durch das umgebende Narbengewebe in der chirurgischen Tasche zurückgehalten (intrakapsulär) und kann nur mit Hilfe von Magnetresonanz- Bildgebungsverfahren erkannt werden (unauffällige Ruptur), die eine Rissbildung zu ca. 85 % effizient erkennen. Wenn das umgebende Narbengewebe eingerissen ist, kann das Gel in die umgebenden Gewebeschichten und in das Brustgewebe eindringen (extrakapsulär). Der größte Teil des ausgetretenen Gels verbleibt in der unmittelbaren Umgebung der Brust; jedoch wurde in seltenen Fällen von einer Ausbreitung entlang des Arms, in Nervenscheiden oder in die Bauchwand berichtet. Diese Rupturen, bei denen das Gel aus dem Narbengewebe ausgetreten ist, können eventuell auch mit Ultraschall, Mammographie und klinischer Untersuchung diagnostiziert werden. Die meisten dieser Fälle traten bei den empfindlicheren Implantaten mit dünnerer Hülle auf, die Ende der 1970er Jahre implantiert wurden.
Wenn sich die Beschaffenheit des Implantats ändert, wenn zum Beispiel erstmals ein anhaltendes einseitiges Brennen auftritt, oder wenn sich die Festigkeit, Oberflächenbeschaffenheit oder Form des Implantats ändert, kann dies ebenfalls ein Anzeichen für eine Ruptur sein. Da die meisten Rupturen „stumm“ erfolgen und eine Diagnose ohne chirurgischen Eingriff schwierig ist, ist die tatsächliche Häufigkeit unbekannt. Die heutigen Produkte besitzen eine stärkere und robustere Hülle und das enthaltene Gel ist zäher. Beim Vergleich der zu erwartenden oder tatsächlichen Rupturhäufigkeit von modernen Produkten mit früheren Fällen ist Vorsicht geboten, vor allem, wenn der Hersteller, das Herstellungsjahr und der Produkttyp unbekannt sind, was häufig der Fall ist. Eine Explantation und/oder ein Austausch kann angezeigt sein, wenn das Implantat defekt ist, insbesondere wenn es im Brustparenchym erscheint, da es mit einem Tumor verwechselt werden oder Tumorgewebe verdecken kann.
Zu den Ursachen für den Riss eines Implantats zählen unter anderem: Beschädigung durch chirurgische Instrumente, intraoperatives oder postoperatives Trauma, zu starke Beanspruchung oder Manipulation auf Grund üblicher, alltäglicher Beschäftigungen wie intensive sportliche Betätigung, Kontaktsportarten, manuelle Massage, intimer Kontakt und die für die Mammographie erforderliche Druckausübung.
Veränderung der Brustwarzen- und Brustempfindlichkeit/Brustschmerzen
Jede Operation, bei der die Haut der Brust abgelöst wird, kann zu einer Steigerung oder Verminderung der Empfindlichkeit im Bereich der Brustwarze und des Warzenhofs führen. Diese Veränderungen können unterschiedliche Ausprägungen haben und von vorübergehender oder permanenter Dauer sein. Veränderungen der Empfindlichkeit von Brustwarze und Brust können vereinzelt das sexuelle Empfinden oder das Empfinden beim Stillen beeinträchtigen. Diese Änderungen sind vermutlich auf eine Schädigung oder Zerrung von Nerven während des chirurgischen Eingriffs zurückzuführen. Es gibt für diese Zustände keine spezielle Behandlung.
Die meisten Frauen, die sich einer Brustvergrößerung oder einer Brustrekonstruktion mit einem Brustimplantat unterziehen, werden nach der Operation Schmerzen in der Brust oder im Thorax verspüren. Obwohl diese Schmerzen normalerweise bei den meisten Frauen während des Heilungsverlaufs nach der Operation abklingen, können sie bei einigen Patientinnen chronisch werden. Es besteht ein möglicher Zusammenhang zwischen chronischen Schmerzen und Hämatomen, Migration, Infektion und zu großen Implantaten oder Kapselkontraktur. Beim Riss eines Implantats kann ein plötzlicher starker Schmerz auftreten.
Auswirkungen auf die Mammographie bei der Erkennung von Krebs/Kalkablagerungen
Da Silikon undurchlässig für Röntgenstrahlen ist und so ein Teil der Brust vom Implantat verdeckt wird, kann ein Implantat theoretisch die Früherkennung von Krebs mittels Mammographie beeinträchtigen. Durch neuere Methoden der Brustkompression kann allerdings heute ein größerer Teil der Brust sichtbar gemacht werden. Die meisten Chirurgen sind der Meinung, dass das Implantat andererseits andererseits die Erkennung von Tumoren durch Palpation verbessert. Obwohl dieses Thema von erheblichem theoretischem Interesse ist, ist kein Fall einer verspäteten Erkennung ausschließlich auf Grund des Vorhandenseins eines Implantats bekannt. Frauen mit erhöhtem Brustkrebsrisiko sollten gründlich abwägen, ob sie tatsächlich Brustimplantate wünschen. Da die Brust bei der Mammographie zusammengedrückt wird, kann das Implantat unter Umständen reißen; dies geschieht jedoch nur selten und sollte eine Frau nicht von einer regelmäßigen Vorsorgeuntersuchung abhalten. Vor der Mammographie sollte die Patientin den Arzt bzw. das Röntgenpersonal darüber informieren, dass sie ein Brustimplantat trägt.
Es ist bekannt, dass sich in alten Narben an beliebigen Stellen des Körpers Kalk ablagern kann; so auch im Narbengewebe um das Implantat herum. Kalkablagerungen bilden sich normalerweise erst einige Jahre nach der Operation. Gutartige Kalzifizierungen sind auch auf Mammographien häufig in ansonsten normalem Brustparenchym zu erkennen, selbst in Brustgewebe, das niemals operiert wurde. Diese gutartigen Kalkablagerungen sehen bei Röntgenuntersuchungen normalerweise anders aus als Kalzifizierungen, die Bösartigkeit bedeuten. Ein erfahrener Radiologe kann in der Regel erkennen, ob eine Kalzifikation gutartig oder bösartig ist; jedoch kann mitunter eine Biopsie erforderlich sein, um die Entartung auszuschließen. Es ist nicht nachgewiesen, dass diese Ablagerungen mehr oder weniger häufig bei Frauen mit Implantaten auftreten als bei Frauen ohne Implantate. Nach vielen Jahren können einige Patientinnen eine dünne Kalkschicht im umgebenden Narbengewebe entwickeln. Dies geschieht fast immer in Zusammenhang mit einer Kapselkontraktur, verursacht aber ansonsten keine weiteren bekannten Probleme.
Extrusion des Implantats/Wundheilungsstörung
Eine Hautnekrose und/oder Schorfbildung mit daraus resultierender Extrusion oder Freilegung des Implantats kann auftreten, wenn die Weichteile über dem Implantat unter übermäßiger Spannung stehen, bei einer Überdosierung von Steroiden in der Implantattasche oder bei externen oder perioperativen Traumata.
Dies tritt bei Patientinnen, bei denen eine Brustvergrößerung durchgeführt wurde, relativ selten auf, kommt jedoch bei einer Rekonstruktion nach Mastektomie, bei lokaler Weichteilschädigung und/oder nach Bestrahlung gelegentlich vor. Die vernarbten Bereiche scheinen, insbesondere nach Bestrahlung in diesem Bereich, am verletzlichsten zu sein. Extrudierte Implantate müssen u. U. chirurgisch entfernt werden.
Faltenbildung des Implantats/Unzufriedenheit mit dem kosmetischen Ergebnis/Asymmetrie
Eine sichtbare und/oder fühlbare Faltenbildung bei einem Implantat hängt mit der geringen Dicke des darüber liegenden Gewebes, dem Ausmaß der Kapselkontraktur und der Beschaffenheit der Implantatoberfläche zusammen. Bei herkömmlichen gelgefüllten Implantaten mit glatter Oberfläche kommt es selten zu einer Faltenbildung. Es wurde beschrieben, dass die Faltenbildung durch die Übertragung von autologem Fett an die Oberfläche des Implantats verborgen werden kann. Operationsfehler, vorhandene Asymmetrie oder Deformation, Keloidbildung im Bereich der Hautinzision, zeitliche Unwägbarkeiten, Gewichtszunahme oder -verlust, Schwangerschaft und Stillen können unmittelbar oder später zu einem mangelhaften ästhetischen Ergebnis beitragen.
Im Laufe der Zeit senken sich die Brüste der meisten Frauen − mit oder ohne Implantat − mehr oder weniger (Ptose). Eine Asymmetrie ist normalerweise darauf zurückzuführen, dass eine vorbestehende Ungleichheit zwischen zwei Brüsten nicht vollständig ausgeglichen werden kann. Sie kann auch durch Operationsfehler, ungleichförmige Kontraktur oder eine Ruptur des Implantats verursacht werden.
Durch eine übermäßige Kollagenbildung im Bereich der Hautinzision im Rahmen der Wundheilung kann sich bei Patientinnen eine kosmetisch beeinträchtigende Narbe bilden. Keloide, die schlecht auf Therapien ansprechen, reichen oft über die Ränder der ursprünglichen Narben hinaus und können sich im Laufe der Zeit weiter vergrößern. Hypertrophe Narben sind im Allgemeinen auf den ursprünglichen Hautschnitt begrenzt und sprechen gut auf eine Narbenbehandlung an, wie beispielsweise Kortisoninjektionen zum Abbau des Kollagens oder eine Operation, um die Position, Richtung oder Linienführung der Narbe zu korrigieren.
Mögliche Reaktionen auf Silikon
Im Folgenden finden Sie eine kurze Zusammenfassung der medizinischen Literatur. Mentor ist sich bewusst, dass die vorliegenden Informationen komplexe technische Zusammenhänge beschreiben. Medizinische Ethik und Praxis verlangen jedoch, dass der Arzt eine Vermittlerrolle zwischen den Herstellern verschreibungspflichtiger medizinischer Produkte und den Patienten übernimmt. Die Möglichkeit eines Zusammenhangs zwischen Silikon (und anderen implantierbaren Materialien) und verschiedenen Erkrankungen wird seit langem
kontrovers in wissenschaftlichen und medizinischen Kreisen diskutiert. Zu den diskutierten Themen gehören immunologische und neurologische Erkrankungen, Karzinogenität und Bindegewebserkrankungen.
Trotz zahlreicher einzelner Berichte von bekannten und neu beschriebenen Bindegewebserkrankungen, die auf das Implantat zurückgeführt werden, haben viele epidemiologische Studien übereinstimmend gezeigt, dass kein eindeutiger Zusammenhang zwischen Silikon-Brustimplantaten und einer bekannten oder neuen Bindegewebs- oder anderen immunologischen Erkrankung nachgewiesen werden kann. Vier bekannte fachübergreifende wissenschaftliche Expertengremien haben jetzt die veröffentlichte Literatur zu diesem Thema, vor allem in Bezug auf Silikon-Brustimplantate, gründlich überprüft und einen ausführlichen Bericht über ihre Erkenntnisse verfasst. Zu diesen Expertengremien gehören die Independent Review Group (beauftragt durch den Chief Medical Officer von Großbritannien), das National Science Panel (bestellt durch Richter Pointer für MDL 926), das Institute of Medicine (IOM) sowie das vom Europäischen Parlament beauftragte Gremium Scientific and Technical Options Assessment (STOA). Diese vier Gremien kamen einheitlich zu dem Ergebnis, dass ein kausaler Zusammenhang oder rein positives Risikoverhältnis zwischen dem Vorhandensein eines Silikon-Brustimplantats und bekannten oder neuen Autoimmun- oder Bindegewebserkrankungen nicht nachzuweisen ist. Im Wesentlichen das gleiche Ergebnis wurde in einer 2011 aktualisierten Übersicht der Epidemiologie-Literatur berichtet, die 2011 in einer „peer-reviewed“ medizinischen Zeitschrift veröffentlicht wurde.3
Bei einer kleinen Anzahl von Patientinnen mit Brustimplantaten sind koinzident neurologische Krankheiten wie Multiple Sklerose und ALS (Amyotrophe Lateralsklerose) aufgetreten. Nachfolgende Untersuchungen haben keinen Zusammenhang zwischen einer neurologischen Erkrankung und Brustimplantaten gezeigt.
Es wurden einige Untersuchungen durchgeführt, um das karzinogene Risiko von Brustimplantaten zu ermitteln. Ein erhöhtes Krebsrisiko konnte nicht festgestellt werden. Die kontinuierliche Einschätzung von bekannten und möglichen Risiken in Zusammenhang mit Brustimplantaten wird fortgeführt.
In der Fachliteratur sind keine zuverlässigen Berichte über Geburtsfehler oder andere Fortpflanzungsanomalien beim Menschen in Zusammenhang mit der Implantation von Silikon- Brustimplantaten beliebiger Art bekannt. In jüngeren, von Mentor finanzierten Studien wurde nachgewiesen, dass die in Brustimplantaten verwendeten Silikonmaterialien in Tierversuchen keine teratogenen Auswirkungen haben.
Obwohl theoretisch jede Brustoperation, also auch eine Implantation, die Stillfähigkeit einer Frau beeinträchtigen kann, haben dennoch viele Frauen mit Brustimplantaten ihre Säuglinge problemlos gestillt. Es ist bekannt, dass jede Brustoperation, zum Beispiel eine Brustbiopsie, die Menge der erzeugten Milch beeinflussen kann. In den letzten Jahren hat sich die Frage gestellt, ob bei Frauen mit silikongelgefüllten Brustimplantaten Silikon in die Muttermilch übergehen und dem Säugling schaden kann. In jüngeren Studien konnte jedoch nachgewiesen werden, dass es keinen Zusammenhang zwischen Silikon-Brustimplantaten und negativen Auswirkungen auf gestillte Säuglinge gibt. Die American Academy of Pediatrics hat festgestellt, dass es keinen Grund gibt, warum eine Frau mit Implantaten nicht stillen sollte. Das European Committee on Quality Assurance and Medical Devices in Plastic Surgery (EQUAM) kam im Jahr 2000 zu der Schlussfolgerung, dass sich silikongelgefüllte Brustimplantate weder auf die Schwangerschaft und die Fötusentwicklung noch auf das Stillen oder die Gesundheit von Säuglingen negativ auswirken.
In dem vom IOM finanzierten Bericht „Safety of Silicone Breast Implants“, der im Juli 1999 herausgegeben wurde, wird darauf hingewiesen, dass bei Frauen mit Silikon-Brustimplantaten kein höheres Risiko für Krebs- und immunologische Erkrankungen oder neurologische Probleme besteht als bei der restlichen Bevölkerung. Das Komitee stellte auch fest, dass es keinen Nachweis dafür gibt, dass Mütter mit Implantaten beim Stillen Silikon über die Muttermilch an ihre Säuglinge weitergeben.
Anaplastisches großzelliges Lymphom
Ausgehend von den an die Aufsichtsbehörden weltweit berichteten und in der medizinischen Literatur gefundenen Informationen wurde ein Zusammenhang zwischen Brustimplantaten und der Entstehung eines anaplastischen großzelligen Lymphoms (ALCL) festgestellt, das einem Non-Hodgkin-Lymphom zuzuordnen ist.4 Bei Frauen mit Brustimplantaten besteht ein sehr kleines, jedoch erhöhtes Risiko, dass sich ein ALCL in der Flüssigkeit oder in der Narbenkapsel neben dem Implantat entwickelt. Hierbei wurde die Möglichkeit für eine lokale und regionale Metastasierung und die Bildung von Fernmetastasen des Lymphoms dokumentiert, in seltenen Fällen auch mit letalem Ausgang.
BIA-ALCL wurde weltweit bei Patientinnen mit einer Implantatgeschichte berichtet, die Brustimplantate von Mentor und anderen Herstellern mit unterschiedlichen Oberflächeneigenschaften, Designs und Formen umfasst. Die meisten Berichte in der Fachliteratur beziehen sich auf eine Verwendungsgeschichte mit texturierten Implantaten. Die Risikofaktoren für die Entstehung eines BIA-ALCL wurden in mehreren Fachartikeln behandelt; als Erkrankungsursache diskutiert wurden u. a. die unterschiedlichen Methoden zur Schaffung einer texturierten Implantatoberfläche sowie die Rolle des Biofilms.
Die Möglichkeit für ein BIA-ALCL berücksichtigen, wenn eine Patientin mit einem verzögert einsetzenden Serom (mindestens 1 Jahr und durchschnittlich 7 bis 10 Jahre nach der Implantation), einer Raumforderung neben der Implantatkapsel in der Brust oder einer Lymphadenopathie vorstellig wird. Die Beurteilung einer verzögert einsetzenden Vergrößerung einer zuvor mit einem Implantat versorgten Brust umfasst eine Ultraschalluntersuchung oder MRT zur Identifizierung eines möglicherweise vorliegenden Seroms oder Lymphoms. Bei positivem Befund erfolgt zur weiteren diagnostischen Abklärung eine Feinnadelaspiration, bei der soviel Flüssigkeit wie möglich (mindestens 50 ml) entnommen wird. Die Feinnadelaspiration erfolgt ultraschallgeführt, um das Implantat entsprechend zu verlagern und zu schützen. Bei einer verdächtigen Raumforderung ist eine Nadel- oder offene Gewebebiopsie erforderlich. Die Proben müssen zur zellmorphologischen Untersuchung auf Grundlage von zytologischem Status, CD30-Immunhistochemie, ALK-Status (anaplastische Lymphomkinase) und Durchflusszytometrie zur Bestimmung, Quantifizierung und Charakterisierung der T-Zellen in der Probe eingesendet werden. Zudem wird dringend eine hämatopathologische Konsultation an einem tertiären Krebsversorgungszentrum empfohlen, um
ein BIA-ALCL diagnostisch zu bestätigen oder auszuschließen. Bei diagnostischer Bestätigung eines BIA-ALCL wird dringend empfohlen, ein multidisziplinäres Team zu konsultieren, das u. a. aus Onkologen, Pathologen, chirurgischen Onkologen und plastischen Chirurgen besteht. Die Leitlinien des US-amerikanischen National Comprehensive Cancer Network (NCCN) zur Behandlung eines bestätigten BIA-ALCL umfassen die Entfernung des Implantats und der gesamten umgebenden Implantatkapsel sowie der betroffenen Raumforderung und der Lymphknoten.7
Bitte alle bestätigten Fälle eines BIA-ALCL gemäß den Angaben unter MELDUNG UNERWÜNSCHTER EREIGNISSE melden.
Auf der FDA-Website sind zusätzliche Informationen in Bezug auf Fragen und Antworten zum BIA-ALCL zu finden: http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/ ImplantsandProsthetics/BreastImplants/ucm239995.htm
Die neuesten Optionen zu Diagnostik und Behandlung sind in den Leitlinien des National Comprehensive Cancer Network (NCCN) aufgeführt.
GeI-Bleeding
Das Gel in einem Implantat besteht aus sehr großen, dreidimensionalen netzartigen Einzelmolekülen, die etwa 20 % des Gesamtvolumens ausmachen. Die Räume zwischen den Molekülen werden mit medizinisch reiner viskoser Silikonflüssigkeit gefüllt. Diese viskose Flüssigkeit ähnelt Materialien, die in vielen rezeptfreien Medikamenten für Kinder und Erwachsene verwendet werden, beispielsweise in Medikamenten gegen Blähungen. Eine geringe Menge dieses Materials kann durch Diffusion oder Bleeding durch die Hülle des Implantats nach außen gelangen. Der größte Teil des Materials bleibt auf der Implantatwand. Eine kleinere Menge gelangt in die umgebende Narbenkapsel, wo die Flüssigkeit allmählich von den Makrophagen aufgenommen wird. In der Regel versuchen diese Zellen, Fremdmaterial wie zum Beispiel Bakterien zu zerstören. Wenn jedoch das Material (wie zum Beispiel Silikon) nicht zerstört werden kann, wird es von den Makrophagen zu den Lymphdrüsen transportiert. Wie im Abschnitt Mögliche Reaktionen auf Silikon angegeben, kam der im Jahr 2000 veröffentlichte STOA-Bericht zu folgendem Schluss: „Aus den durchgeführten Studien ergaben sich keinerlei Hinweise auf einen Zusammenhang zwischen Implantaten aus Silikon und schweren Gesundheitsrisiken wie Krebs und Bindegewebserkrankungen.“
Granulome
Ein Granulom kann sich auch um kleinste Mengen Silikon bilden. Obwohl diese Knötchen nicht krebsartig sind, lassen sie sich unter Umständen schwer von Krebsgeschwülsten unterscheiden, wenn sie nicht (mittels einer Biopsie) entfernt und untersucht werden. Größere Granulome oder Granulome mit Verdacht auf Malignität müssen mittels Biopsie oder chirurgisch entfernt und untersucht werden.
Weitere mögliche Reaktionen
- Vereinzelt kam es im Bereich des Implantats zur Bildung von Venenthrombosen, die dicken Schnüren ähneln und die sich ohne chirurgischen Eingriff oder medizinische Therapie wieder aufgelöst haben.
- Ein Implantat von ungeeigneter Größe und/oder in ungeeigneter Position kann durch Nervenkompression oder Behinderung von Muskelbewegungen Schmerzen hervorrufen.
- Es sind hypertrophe Narben aufgetreten.
- Die Explantation des Implantats kann durch ausgeprägte Gewebeverklebungen erschwert werden.
Anweisungen und Vorsichtsmaßnahmen zur Implantatentfernung
Falls das Implantat entfernt werden muss, sollten die chirurgischen Standardzugänge und -praktiken angewendet werden. Das Implantat muss vollständig entfernt werden. Falls ein Implantat, das Gel enthält, reißt, ist sämtliches Gel soweit möglich zu entfernen.
MELDUNG UNERWÜNSCHTER EREIGNISSE
Gilt für Patienten/Anwender/Dritte in der Europäischen Union und in Ländern mit identischem Regulierungssystem: Wenn es während oder infolge der Anwendung dieses Produkts zu einem schwerwiegenden Vorfall gekommen ist, melden Sie dies bitte dem Hersteller und/oder dessen bevollmächtigtem Vertreter sowie der zuständigen Behörde des Landes.
PRODUKTBEWERTUNG
Mentor verlangt, dass jegliche Komplikationen und/oder Explantationen, die im Zusammenhang mit der Verwendung dieses Produkts stehen, umgehend Ihrer örtlichen Mentor-Vertretung gemeldet werden, die dafür verantwortlich ist, die Abteilung Mentor Product Complaint zu informieren. Im Falle einer erforderlichen Explantation wird das explantierte Produkt analysiert; diePatientin und der Arzt müssen gebeten werden, die Durchführung bestimmter Tests zu gestatten, die den Zustand des Produkts verändern können.
PRODUKTRÜCKGABE
Die Genehmigung zur Rückgabe eines Artikels ist vor der Warenrückgabe bei der zuständigen lokalen Mentor-Vertretung einzuholen. Die Bereitstellung eines Ersatzimplantats oder eine Gutschrift ist nur möglich, wenn bei der Rücksendung alle Herstellersiegel intakt sind. Für zurückgegebene Artikel kann eine Rücknahmegebühr erhoben werden.
SICHERE ENTSORGUNG
Produkte, die in Kontakt mit Materialien menschlichen Ursprungs gekommen sind, können infektiös sein. Das Produkt unter Einhaltung der erforderlichen Sicherheitsmaßnahmen und in Übereinstimmung mit den vor Ort geltenden Bestimmungen entsorgen. Hinweis: Produkte, die mit Reklamationen oder einem potenziellen unerwünschten Ereignis in Zusammenhang stehen, umgehend der zuständigen Mentor-Vertretung melden und eine Rücksendung veranlassen (siehe Abschnitt „PRODUKTBEWERTUNG“ oben).
OFFENLEGUNG VON PRODUKTINFORMATIONEN
Mentor lehnt ausdrücklich alle Gewährleistungen ab, ob mündlich oder schriftlich, gesetzlich verankert, ausdrücklich oder stillschweigend, kraft des Gesetzes oder anderweitig, einschließlich, jedoch nicht beschränkt auf, alle stillschweigenden Gewährleistungen bezüglich der handelsüblichen Qualität der Ware, deren Eignung oder Beschaffenheit. Mentor übernimmt keine Haftung für alle direkten, beiläufigen und Folgeschäden, Kosten oder Folgeverluste, die direkt oder indirekt aus der Verwendung dieses Produktes entstehen. Keinerlei Darstellungen oder andere Erklärung von Tatsachen, einschließlich, jedoch nicht beschränkt auf, Aussagen bezüglich der Anwendbarkeit oder Funktion des Produktes, werden von Mentor als Garantiegrundlage betrachtet. Weder übernimmt noch autorisiert Mentor eine andere oder zusätzliche Haftung oder Verantwortung in Zusammenhang mit diesem Produkt.
BESTELLINFORMATIONEN
Für weitere Produktinformationen oder direkte Bestellungen wenden Sie sich an Ihre Mentor-Vertretung vor Ort.
INFORMATIONEN FÜR DIE PATIENTIN
Bei der Versorgung mit Brustimplantaten handelt es sich um einen elektiven Eingriff. Die Patientin muss gut über das Nutzen-Risiko-Verhältnis aufgeklärt werden. Der behandelnde Chirurg muss jeder potenziellen Patientin Folgendes zur Verfügung stellen:
- Gelgefüllte Brustimplantate: Informieren Sie sich, bevor Sie eine Entscheidung treffen
Diese Broschüre dient der Aufklärung der Patientin bezüglich der Risiken und der Vorteile von gelgefüllten Brustimplantaten und der damit in Zusammenhang stehenden Operation. Die Patientin ist anzuweisen, sich nach dem Durchgehen der Informationen eine Woche Bedenkzeit zu nehmen, bevor sie eine Entscheidung bezüglich der chirurgischen Augmentation trifft.
- Produktmaterialien
Die gelgefüllten Brustimplantate von MENTOR® erfüllen die Anforderungen zur Biokompatibilität gemäß ISO 10993. Die Materialien, mit denen Patientinnen in Kontakt kommen können, bestehen zu 100 % aus Silikon für medizinische Implantatzwecke. Die Hüllen der gelgefüllten Brustimplantate von MENTOR® bestehen aus Silikonelastomer für klinische Anwendungen. DieHülle ist mit einem kohäsiven Silikongel für klinische Anwendungen gefüllt.
- Erwartete Lebensdauer des Produkts und Nachbeobachtung
Unabhängig davon, ob es sich um eine Augmentation oder eine Rekonstruktion handelt, muss sich die Patientin darüber im Klaren sein, dass es sich bei einer Brustimplantation möglicherweise nicht um einen einmaligen Eingriff handelt. Wahrscheinlich sind zusätzliche Arztbesuche nötig und möglicherweise müssen im Laufe der Zeit bei Brustimplantatträgerinnen weitere Operationen durchgeführt werden. Je länger die Brustimplantate getragen werden, desto höher ist die Wahrscheinlichkeit für das Auftreten von Komplikationen, die möglicherweise weitere Operationen erfordern.
Brustimplantate gelten nicht als Implantate, die ein ganzes Leben lang getragen werden können. Brustimplantate müssen im Laufe der Zeit möglicherweise entfernt oder ausgetauschtwerden.Auf Grundlage der untenstehenden Informationen ist davon auszugehen, dass die Brustimplantate MENTOR® MemoryGel® und Contour Profile® (CPG) eine durchschnittliche Lebensdauer von zehn Jahren haben.Die zu erwartende Lebensdauer von MENTOR® Brustimplantaten basiert auf den geschätzten Rupturraten der Implantate. Es gibt zahlreiche Gründe für Brustimplantatrupturen, dazu gehören Verschleiß und Abnutzung des Implantats im Laufe der Zeit infolge der normalen Körperbewegungen, eine unbeabsichtigte Beschädigung durch spitze/scharfe Instrumente während der Operation sowie physische Belastungen, beispielsweise durch einen Autounfall oder starke körperliche Betätigung. Die Rupturraten können je nach angewendetem Verfahren bei der Brustimplantatversorgung variieren. In klinischen Studien von MENTOR® unterzogen sich Patientinnen zur Untersuchung auf eine mögliche Ruptur ihres Implantats in regelmäßigen Abständen einem MRT-Screening. Dabei ist es wichtig zu wissen, dass es bei den meisten Patientinnen mit Implantatruptur zu keinen Symptomen kommt.
Geschätzte Rupturraten im zeitlichen Verlauf bei MENTOR® Brustimplantaten in klinischen Studien von MENTOR®.
Diese Raten wurden auf Grundlage der Kaplan-Meier-Analyse berechnet. Bei der Kaplan-Meier-Analyse werden Patientinnen berücksichtigt, die Nachbeobachtungstermine nicht wahrnehmen, und die geschätzte Rupturrate wird entsprechend angepasst. Diese Rupturraten umfassen sowohl Rupturen, bei denen es sich um einen Verdacht handelt, als auch Rupturen, die gemäß untenstehender Definition bestätigt wurden.
Rupturen, bei denen es sich um einen Verdacht handelt, sind Rupturen, die auf Grundlage von MRT-Befunden vermutet, jedoch nach chirurgischer Abklärung und implantatbezogener körperlicher Untersuchung nicht bestätigt werden konnten; normalerweise, weil sich die Patientin dagegen entschied, das Implantat entfernen zu lassen.
Bestätigte Rupturen sind Rupturen, die durch Untersuchung des Implantats nach Explantation bestätigt wurden.
Bei allen Rupturen, die insgesamt für das jeweilige Implantat gemeldet wurden (sowohl bestätigte Rupturen, als auch Rupturen, die zwar vermutet, aber nicht bestätigt wurden), betrug der Anteil an bestätigten Rupturen bei MENTOR® MemoryGel® Brustimplantaten 64 % (49 von 77 vermuteten oder bestätigten Rupturen) und bei Contour Profile® (CPG) Brustimplantaten 47 % (8von 17 vermuteten oder bestätigten Rupturen).
10-Jahres-Raten für vermutete oder bestätigte Implantatrupturen bei MENTOR® MemoryGel® Brustimplantaten:
| Primäre Augmentation | Revisionsaugmentation | Primäre Rekonstruktion | Revisionsrekonstruktion |
| 14,9 % | 16,5 % | 24,3 % | 25,8 % |
Die 10-Jahres-Nachbeobachtungsrate betrug 53 %, daher ist die Aussagekraft der Daten begrenzt.
10-Jahres-Raten für vermutete oder bestätigte Implantatrupturen bei Contour Profile® (CPG) Brustimplantaten:
| Primäre Augmentation | Revisionsaugmentation | Primäre Rekonstruktion | Revisionsrekonstruktion |
| 3,3 % | 4,7 % | 11,2 % | 0 % |
Die 10-Jahres-Nachbeobachtungsrate betrug 45 %, daher ist die Aussagekraft der Daten begrenzt.
- Patientenpass
Jedem gelgefüllten Brustimplantat liegt ein Patientenpass bei. Zum Ausfüllen des Patientenpasses einen Aufkleber zur Dokumentation je Implantat auf die Rückseite des Patientenpasses kleben. Die Aufkleber zur Dokumentation sind am Etikett der inneren Produktverpackung angebracht. Falls sich die Aufkleber zur Dokumentation nicht in der Verpackung befinden, können die Chargennummer, die Katalognummer und die Beschreibung des Implantats handschriftlich vom Implantatetikett übernommen werden. Der Patientenpass ist der Patientin zur Aufbewahrung auszuhändigen.Die implantatspezifischen Informationen werden sowohl auf der Implantatkarte vermerkt als auch in der Krankenakte der Patientin in der entsprechenden Einrichtung hinterlegt. Die Karte mit den produktspezifischen Informationen zur Identifizierung des jeweiligen Medizinprodukts wird der Patientin vom Arzt ausgehändigt.
LITERATURVERWEISE
- Halpern, J., McNeese, M.D., Kroll, S.S. and Ellerbroek, N. Irradiation of Prosthetically Augmented Breasts: A Retrospective Study of Toxicity and Cosmetic Results. Int. Jour. Radiat. Oncol. Biol.Phys.18: 189, 1990.
- Spear, S.L. and Onyewu, C. Staged Breast Reconstruction with Saline-Filled Implants in the Irradiated Breast: Recent Trends and Therapeutic Implications. Plast. Reconstr. Surg. 105: 930, 2000.
- Lipworth, L., L.R. Holmich and J.K. McLaughlin. 2011. Silicone breast implants and connective tissue disease: no association. Semin. Immunopathol. 33(3):287-294.
- de Jong, D. et al. 2008. Anaplastic Large-Cell Lymphoma in Women With Breast Implants. JAMA. 300: 2030-2035, 2008.
- ISO 14607: 2009, Non-active surgical implants – Mammary Implants – Particular Requirements
- Chen et aL. The Influence of Connective Tissue Disease in Breast Reconstruction: A National Database Analysis. Annals of Plastic Surgery Vol 80. Supplement 4. April 2018
- https://www.nccn.org/professionals/physician_gls/recently_updated.aspx
Die aktuelle Version dieses Dokuments finden Sie unter www.e-ifu.com.